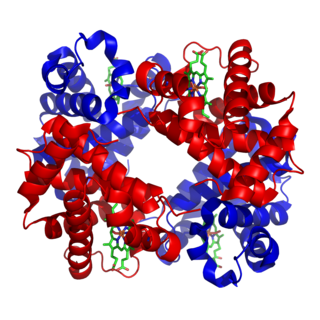
Авидин
| Авидин | |
|---|---|
 Тетрамерная структура стрептавидина с 2 связанными биотинами | |
| Идентификаторы | |
| Символ | Авидин |
| Pfam | PF01382 |
| PROSITE | PDOC00499 |
| SCOP | 1slf |
| SUPERFAMILY | 1slf |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |

Авидин представляет собой тетрамерный биотин-связывающий белок, вырабатываемый в яйцеводах птиц, рептилий и амфибий и откладывающийся в белке их яиц. Димерные члены семейства авидинов также обнаружены в некоторых бактериях[1]. В белке куриного яйца авидин составляет примерно 0,05 % от общего белка (примерно 1800 г). мкг на яйцо). Тетрамерный белок содержит четыре идентичные субъединицы (гомотетрамеры), каждая из которых может связываться с биотином (витамин В7, витамин Н) с высокой степенью аффинности и специфичности. Измеренная константа диссоциации авидин-биотинового комплекса составляет KD ≈ 10-15M, что делает его одной из самых прочных известных нековалентных связей[2].
Размер тетрамерной формы авидина оценивается в 66-69 кДа[3]. 10 % молекулярной массы составляют углеводы, состоящие из четырёх-пяти остатков маннозы и трех остатков N-ацетилглюкозамина[4]. Углеводные фрагменты авидина содержат как минимум три уникальных структурных типа олигосахаридов, сходных по структуре и составу[5].
Функциональный авидин содержится только в сыром яйце, так как биотиновое сродство белка разрушается при варке. Естественная функция авидина в яйцах неизвестна, хотя постулируется, что он вырабатывается в яйцеводе в качестве ингибитора роста бактерий путем связывания биотина, полезного для роста бактерий. В качестве доказательства этого можно привести стрептавидин, родственный белок с таким же сродством к биотину и очень похожим сайтом связывания, который вырабатывается некоторыми штаммами бактерий Streptomyces и, как считается, служит для подавления роста конкурирующих бактерий наподобие антибиотика[6].
Из коммерчески доступного продукта была выделена негликозилированная форма авидина; однако неясно, встречается ли негликозилированная форма в природе или является продуктом производственного процесса[7].
Открытие

Авидин был открыт Эсмондом Эмерсоном Снеллом (1914—2003). Это открытие началось с наблюдения, что у цыплят на диете из сырого яичного белка наблюдается дефицит биотина, несмотря на наличие витамина в их рационе[8]. Был сделан вывод, что компонент яичного белка связывал биотин[8], что Снелл подтвердил in vitro с помощью анализа на дрожжах[9]. Позже Снелл выделил компонент яичного белка, ответственный за связывание биотина, и в сотрудничестве с Полом Дьердь подтвердил, что изолированный яичный белок был причиной дефицита биотина или «повреждения яичного белка». В то время исследователи из Техасского университета предварительно назвали этот белок авидальбумином (буквально «голодный альбумин»)[9]. Позже название белка было изменено на «авидин» из-за его сродства к биотину (авидин + биотин)[10].
Приложения
Исследования 1970-х годов помогли сделать систему авидин-биотин мощным инструментом биологических наук. Зная о силе и специфичности авидин-биотинового комплекса, исследователи начали использовать куриный авидин и стрептавидин в качестве зондов и матриц сродства в многочисленных исследовательских проектах[11][12][13][14]. Вскоре после этого исследователи Байер и Вилчек разработали новые методы и реагенты для биотинилирования антител и других биомолекул[15][16], что позволило использовать систему авидин-биотин в ряде биотехнологических приложений. Сегодня авидин используется в самых разных областях, от исследований и диагностики до медицинских устройств и фармацевтики.
Сродство авидина к биотину используется в широком спектре биохимических анализов, включая вестерн-блоттинг, ELISA, ELISPOT и нисходящие анализы. В некоторых случаях использование биотинилированных антител позволило заменить меченные радиоактивным йодом антитела в системах радиоиммунного анализа, чтобы получить нерадиоактивную систему анализа.
Авидин, иммобилизованный на твердых носителях, также используется в качестве очищающей среды для захвата меченого биотином белка или молекул нуклеиновой кислоты. Например, белки клеточной поверхности могут быть специфически помечены биотиновым реагентом, непроницаемым для мембран, а затем специфически захвачены с использованием носителя на основе авидина.
Модифицированные формы
В качестве основного заряженного гликопротеина авидин проявляет неспецифическое связывание в некоторых применениях. Нейтравидин, дегликозилированный авидин с модифицированными аргининами, имеет более нейтральную изоэлектрическую точку (pI) и доступен в качестве альтернативы нативному авидину, когда возникают проблемы неспецифического связывания. Дегликозилированные нейтральные формы куриного авидина доступны через Sigma-Aldrich (Extravidin), Thermo Scientific (NeutrAvidin), Invitrogen (NeutrAvidin) и e-Proteins (NeutraLite).
Учитывая прочность авидин-биотиновой связи, диссоциация авидин-биотинового комплекса требует экстремальных условий, вызывающих денатурацию белка. Необратимый характер авидин-биотинового комплекса может ограничивать применение авидина в аффинной хроматографии, где желательно высвобождение захваченного лиганда. Исследователи создали авидин с обратимыми характеристиками связывания за счет нитрования или йодирования тирозина в сайте связывания[17]. Модифицированный авидин проявляет сильные характеристики связывания биотина при рН 4 и высвобождает биотин при рН 10 или выше[17]. Мономерная форма авидина с пониженным сродством к биотину также используется во многих коммерчески доступных аффинных смолах. Мономерный авидин создается обработкой иммобилизованного нативного авидина мочевиной или гуанидином HCl (6-8 М), придающей ему более низкую диссоциацию KD ≈ 10-7 М[18]. Это позволяет элюировать из матрицы авидина в более мягких, неденатурирующих условиях, с использованием низких концентраций биотина или условий с низким pH. Для одного сайта связывания биотина с высокой аффинностью без сшивки можно использовать моновалентную версию дальнего родственника авидина, стрептавидина[19].
Блокирование связывания биотина
Термическая стабильность и биотинсвязывающая активность авидина представляют как практический, так и теоретический интерес для исследователей, поскольку стабильность авидина необычно высока, а авидин является антинутриентом в пище человека[20]. Исследование 1966 года, опубликованное в журнале Biochemical and Biophysical Research Communications, показало, что структура авидина остается стабильной при температуре ниже 70 °C (158 °F) °С. . Выше 70 °C (158 °F), структура авидина быстро разрушается и к 85 °C (185 °F) обнаруживается обширная потеря структуры и потеря способности связывать биотин[21]. Анализ, проведенный в 1991 году для Journal of Food Science, выявил существенную активность авидина в варёном яичном белке: "средняя остаточная активность авидина в жареном, варёном и варёном (2 минуты) яичном белке составляла 33, 71 и 40 % активности в сыром яичном белке. " Анализ показал, что времени приготовления было недостаточно для адекватного нагревания всех холодных участков в яичном белке. Полная инактивация биотинсвязывающей способности авидина требует кипячения более 4 минут[22].
Исследование 1992 года показало, что термическая инактивация биотинсвязывающей активности авидина была описана D 121 . °C = 25 мин и z = 33 °С. Это исследование противоречило предыдущим предположениям, «что сайт связывания авидина разрушается при тепловой денатурации»[20].
Биотин-связывающие свойства авидина были использованы при разработке идрабиотапаринукса, низкомолекулярного гепарина длительного действия, используемого для лечения венозного тромбоза . Из-за пролонгированного действия идрапаринукса были высказаны опасения по поводу клинического лечения геморрагических осложнений. При добавлении фрагмента биотина к молекуле идрапаринукса образуется идрабиотапаринукс; его антикоагулянтную активность в условиях кровотечения можно отменить путем внутривенного вливания авидина[23].
См. также
Использованная литература
- ↑ Satu H. Helppolainen, Kirsi P. Nurminen, Juha A. E. Määttä, Katrin K. Halling, J. Peter Slotte. Rhizavidin from Rhizobium etli: the first natural dimer in the avidin protein family // The Biochemical Journal. — 2007-08-01. — Т. 405, вып. 3. — С. 397–405. — ISSN 1470-8728. — doi:10.1042/BJ20070076. Архивировано 28 сентября 2022 года.
- ↑ N. M. Green. AVIDIN. 1. THE USE OF (14-C)BIOTIN FOR KINETIC STUDIES AND FOR ASSAY // The Biochemical Journal. — 1963-12. — Т. 89. — С. 585–591. — ISSN 0264-6021. — doi:10.1042/bj0890585. Архивировано 27 сентября 2022 года.
- ↑ J. Korpela. Avidin, a high affinity biotin-binding protein, as a tool and subject of biological research // Medical Biology. — 1984. — Т. 62, вып. 1. — С. 5–26. — ISSN 0302-2137. Архивировано 28 сентября 2022 года.
- ↑ N. M. Green. Avidin // Advances in Protein Chemistry. — 1975. — Т. 29. — С. 85–133. — ISSN 0065-3233. — doi:10.1016/s0065-3233(08)60411-8. Архивировано 23 сентября 2022 года.
- ↑ R. C. Bruch, H. B. White. Compositional and structural heterogeneity of avidin glycopeptides // Biochemistry. — 1982-10-12. — Т. 21, вып. 21. — С. 5334–5341. — ISSN 0006-2960. — doi:10.1021/bi00264a033. Архивировано 27 сентября 2022 года.
- ↑ W. A. Hendrickson, A. Pähler, J. L. Smith, Y. Satow, E. A. Merritt. Crystal structure of core streptavidin determined from multiwavelength anomalous diffraction of synchrotron radiation // Proceedings of the National Academy of Sciences of the United States of America. — 1989-04. — Т. 86, вып. 7. — С. 2190–2194. — ISSN 0027-8424. — doi:10.1073/pnas.86.7.2190. Архивировано 28 сентября 2022 года.
- ↑ Y. Hiller, J. M. Gershoni, E. A. Bayer, M. Wilchek. Biotin binding to avidin. Oligosaccharide side chain not required for ligand association // The Biochemical Journal. — 1987-11-15. — Т. 248, вып. 1. — С. 167–171. — ISSN 0264-6021. — doi:10.1042/bj2480167. Архивировано 29 сентября 2022 года.
- ↑ 1 2 R. E. Eakin, W. A. McKinley, R. J. Williams. EGG-WHITE INJURY IN CHICKS AND ITS RELATIONSHIP TO A DEFICIENCY OF VITAMIN H (BIOTIN) // Science (New York, N.Y.). — 1940-09-06. — Т. 92, вып. 2384. — С. 224–225. — ISSN 0036-8075. — doi:10.1126/science.92.2384.224. Архивировано 29 сентября 2022 года.
- ↑ 1 2 Esmond E. Snell, Robert E. Eakin, Roger J. Williams. A Quantitative Test for Biotin and Observations Regarding its Occurrence and Properties (англ.) // Journal of the American Chemical Society. — 1940-01. — Vol. 62, iss. 1. — P. 175–178. — ISSN 1520-5126 0002-7863, 1520-5126. — doi:10.1021/ja01858a052. Архивировано 24 сентября 2022 года.
- ↑ Nicole Kresge, Robert D. Simoni, Robert L. Hill. The Discovery of Avidin by Esmond E. Snell (англ.) // Journal of Biological Chemistry. — 2004-10. — Vol. 279, iss. 41. — P. e5–e6. — doi:10.1016/S0021-9258(20)77095-X. Архивировано 13 января 2021 года.
- ↑ K. Hofmann, Y. Kiso. An approach to the targeted attachment of peptides and proteins to solid supports // Proceedings of the National Academy of Sciences of the United States of America. — 1976-10. — Т. 73, вып. 10. — С. 3516–3518. — ISSN 0027-8424. — doi:10.1073/pnas.73.10.3516. Архивировано 28 сентября 2022 года.
- ↑ E. A. Bayer, E. Skutelsky, D. Wynne, M. Wilchek. Preparation of ferritin-avidin conjugates by reductive alkylation for use in electron microscopic cytochemistry // The Journal of Histochemistry and Cytochemistry: Official Journal of the Histochemistry Society. — 1976-08. — Т. 24, вып. 8. — С. 933–939. — ISSN 0022-1554. — doi:10.1177/24.8.182877. Архивировано 28 сентября 2022 года.
- ↑ L. Angerer, N. Davidson, W. Murphy, D. Lynch, G. Attardi. An electron microscope study of the relative positions of the 4S and ribosomal RNA genes in HeLa cells mitochondrial DNA // Cell. — 1976-09. — Т. 9, вып. 1. — С. 81–90. — ISSN 0092-8674. — doi:10.1016/0092-8674(76)90054-4. Архивировано 28 сентября 2022 года.
- ↑ M. H. Heggeness, J. F. Ash. Use of the avidin-biotin complex for the localization of actin and myosin with fluorescence microscopy // The Journal of Cell Biology. — 1977-06. — Т. 73, вып. 3. — С. 783–788. — ISSN 0021-9525. — doi:10.1083/jcb.73.3.783. Архивировано 27 сентября 2022 года.
- ↑ E. A. Bayer, M. G. Zalis, M. Wilchek. 3-(N-Maleimido-propionyl)biocytin: a versatile thiol-specific biotinylating reagent // Analytical Biochemistry. — 1985-09. — Т. 149, вып. 2. — С. 529–536. — ISSN 0003-2697. — doi:10.1016/0003-2697(85)90609-8. Архивировано 28 сентября 2022 года.
- ↑ M. Wilchek, H. Ben-Hur, E. A. Bayer. p-Diazobenzoyl biocytin--a new biotinylating reagent for the labeling of tyrosines and histidines in proteins // Biochemical and Biophysical Research Communications. — 1986-07-31. — Т. 138, вып. 2. — С. 872–879. — ISSN 0006-291X. — doi:10.1016/s0006-291x(86)80577-0. Архивировано 8 июля 2022 года.
- ↑ 1 2 E. Morag, E. A. Bayer, M. Wilchek. Reversibility of biotin-binding by selective modification of tyrosine in avidin // The Biochemical Journal. — 1996-05-15. — Т. 316 ( Pt 1). — С. 193–199. — ISSN 0264-6021. — doi:10.1042/bj3160193. Архивировано 28 сентября 2022 года.
- ↑ R. A. Kohanski, M. D. Lane. Monovalent avidin affinity columns // Methods in Enzymology. — 1990. — Т. 184. — С. 194–200. — ISSN 0076-6879. — doi:10.1016/0076-6879(90)84274-k. Архивировано 28 сентября 2022 года.
- ↑ Mark Howarth, Daniel J.-F. Chinnapen, Kimberly Gerrow, Pieter C. Dorrestein, Melanie R. Grandy. A monovalent streptavidin with a single femtomolar biotin binding site // Nature Methods. — 2006-04. — Т. 3, вып. 4. — С. 267–273. — ISSN 1548-7091. — doi:10.1038/nmeth861. Архивировано 28 сентября 2022 года.
- ↑ 1 2 T.D. Durance, N.S. Wong. Kinetics of thermal inactivation of avidin (англ.) // Food Research International. — 1992-01. — Vol. 25, iss. 2. — P. 89–92. — doi:10.1016/0963-9969(92)90148-X. Архивировано 20 июля 2021 года.
- ↑ Alan B. Pritchard, Donald B. McCormick, Lemuel D. Wright. Optical rotatory dispersion studies of the heat denaturation of avidin and the avidin-biotin complex (англ.) // Biochemical and Biophysical Research Communications. — 1966-12. — Vol. 25, iss. 5. — P. 524–528. — doi:10.1016/0006-291X(66)90623-1. Архивировано 20 июля 2021 года.
- ↑ T. D. Durance. Residual Avid in Activity in Cooked Egg White Assayed with Improved Sensitivity (англ.) // Journal of Food Science. — 1991-05. — Vol. 56, iss. 3. — P. 707–709. — ISSN 1750-3841 0022-1147, 1750-3841. — doi:10.1111/j.1365-2621.1991.tb05361.x.
- ↑ Harry R. Büller, Alex S. Gallus, Gerard Pillion, Martin H. Prins, Gary E. Raskob. Enoxaparin followed by once-weekly idrabiotaparinux versus enoxaparin plus warfarin for patients with acute symptomatic pulmonary embolism: a randomised, double-blind, double-dummy, non-inferiority trial // Lancet (London, England). — 2012-01-14. — Т. 379, вып. 9811. — С. 123–129. — ISSN 1474-547X. — doi:10.1016/S0140-6736(11)61505-5. Архивировано 28 сентября 2022 года.
Ссылки
- Яйцо-очень полезное взаимодействие — статья о структуре в Protein Data Bank