Азид натрия
| Азид натрия | |
|---|---|
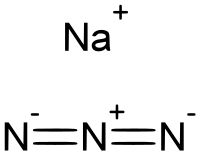 | |
| Общие | |
| Систематическое наименование | азид натрия |
| Традиционные названия | тринитрид натрия |
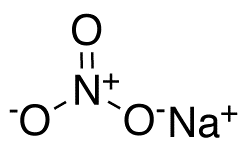
| Хим. формула | NaN3 |
| Рац. формула | NaN3 |
| Внешний вид | white solid |
| Физические свойства | |
| Молярная масса | 65,0099 г/моль |
| Плотность | 1,846 г/см³ |
| Энергия ионизации | 11,7 ± 0,1 эВ[2] |
| Термические свойства | |
| Температура | |
| • плавления | 275 °C[1] |
| • разложения | 527 ± 1 ℉[2] |
| Химические свойства | |
| Растворимость | |
| • в воде | 38,9 г/100 мл (0 °C) |
| • в этаноле | 0,316 г/100 мл[3] |
| • в метаноле | 2,48 г/100 мл (при 25 °C) |
| Структура | |
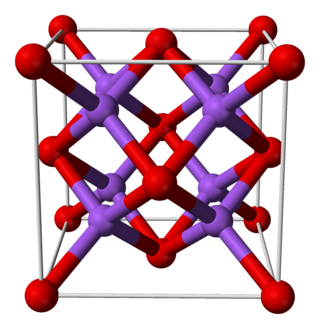
| Кристаллическая структура | гексагональная, hR12[4] |
| Классификация | |
| Рег. номер CAS | 26628-22-8 |
| PubChem | 33557 и 4427778 |
| Рег. номер EINECS | 247-852-1 |
| SMILES | |
| InChI | |
| RTECS | VY8050000 |
| ChEBI | 278547 |
| Номер ООН | 1687 |
| ChemSpider | 30958 |
| Безопасность | |
| ЛД50 | 27 мг/кг (крысы, орально)[4] |
| Токсичность | высокотоксичен |
| Краткие характер. опасности (H) | H300, H410, EUH032 |
| Меры предостор. (P) | P273, P308+P311 |
| Сигнальное слово | опасно |
| Пиктограммы СГС | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Азид натрия — неорганическое вещество с формулой NaN3. Эта бесцветная соль азотистоводородной кислоты является газообразующим компонентом во многих системах подушек безопасности. Как самый доступный азид используется для получения других азидов. Имеет высокую растворимость в воде. Высокотоксичен.
Структура
Азид натрия — ионное твёрдое вещество, существующее в двух полиморфных формах: ромбовидной и гексагональной[4][5].
Получение
Азид натрия чаще всего получают действием аммиака и оксида азота(I) на металлический натрий. Синтез проводят в два этапа. Сначала получают амид натрия:
На полученный продукт действуют оксидом азота(I):
Другой способ заключается во взаимодействии нитрата натрия с амидом натрия[6]:
Также продукт можно получить взаимодействием гидразина с нитритом натрия:
Применение
При аварии с сильным ударом срабатывает датчик ускорения, сигнал этого датчика поджигает газообразующую смесь на основе азида натрия, при этом происходит реакция с большим выделением газообразного горячего азота:
Такая же реакция происходит при нагревании соли до 250—300 °C. Образующийся в качестве побочного вещества натрий сам по себе также опасен, и потому в автомобильных подушках безопасности нейтрализуется такими веществами, как нитрат калия или соединениями кремния. В последнем случае образуется силикат натрия[7]. Сообщений о вреде подобных систем не зарегистрировано[8].
Органический синтез
Азид натрия используется для синтеза органических азидов (например, метилазида, циануртриазида), как источник азотистоводородной кислоты для синтеза Шмидта.

Неорганический синтез
Азид натрия используется как исходное вещество для получения других азидов, например, азида свинца и азида серебра, используемые в качестве инициирующих взрывчатых веществ.
Также применяется для получения особо чистого азота, чистого металлического натрия.
Часто используется как удобный для хранения источник остатка азотистоводородной кислоты для различных синтезов.
Биология и медицина
Азид используется в медицине как пробный реагент, мутаген и консервант[9].
Свойства
Уже при комнатной температуре реагирует с галогенами, нитритами щелочных металлов. При взаимодействии с сильными кислотами выделяет азотистоводородную кислоту:
Водные растворы содержат незначительные количества кислоты:
Азид разлагается при действии на него раствором азотистой кислоты[10]:
Растворы азида натрия следует считать опасными и, если в них нет необходимости, нейтрализовать действием окислителей. Следует избегать воздействия на растворы азида натрия кислот, так как это ведёт к выделению летучей, токсичной и взрывоопасной азотистоводородной кислоты. Описаны[] случаи взрывов при сливании раствора азида в канализацию, за счёт образования азида меди (опасного взрывчатого вещества) и азидов других тяжёлых металлов (в частности, железа и свинца). Описан[] случай взрыва системы, состоявшей из водного раствора азида натрия и слоя дихлорметана (возможно из-за образования диазидометана).
Токсичность

Азид натрия высокотоксичен, симптоматика схожа с той, что имеет место при отравлении цианидом. Большие дозы могут привести к летальному исходу[11].
Симптомы отравления у животных
При отравлении азидом натрия у крыс начинается апатия, тремор конечностей, судороги, цианоз, снижение температуры тела, резкое угнетение дыхания, кома и смерть; у выживших — выпадение шерсти, нефрит. На вскрытии — повреждение миокарда, отёк лёгких и различные кровоизлияния, вакуолизация и жировая дистрофия печени, некрозы в ткани мозга, вакуолизация митохондрий. Ультраструктурные изменения сходны с теми, которые наблюдаются при гиповитаминозе В1. При нанесении азида натрия на спину кроликов можно заметить нарушение вестибулярной хронаксии, снижение подвижности.
Симптомы отравления у человека
При отравлении азидом натрия у человека уже через 5 минут начинается удушье и сильное сердцебиение, через 1,5—4 часа наблюдается слабость, тошнота, падение кровяного давления, сильный понос со слизью, одышка. Смерть наступает в течение периода от 40 минут до 12 часов. На вскрытии явно виден отёк лёгких, многочисленные кровоизлияния в слизистые оболочки внутренних органов, отёк мозга.
Известны случаи отравления азидом натрия, как умышленные, так и неумышленные. Серийный убийца Вячеслав Соловьев использовал азид натрия для убийства своей жены. Также в августе 2009 года сотрудникам одной лаборатории Гарвардского университета потребовалась госпитализация после того, как они выпили кофе из автомата рядом с рабочим помещением. Они испытывали пониженное давление и звон в ушах; один сотрудник упал в обморок. По данным лабораторных исследований, причиной стал азид, попавший в кофе[12][13].
Примечания
- ↑ Разлагается.
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0560.html
- ↑ 1 2 При 16—17 °C.
- ↑ 1 2 3 Stevens E. D., Hope H. A Study of the Electron-Density Distribution in Sodium Azide, NaN3 (англ.) // Acta Crystallographica A[англ.] : journal. — International Union of Crystallography, 1977. — Vol. 33. — P. 723.
- ↑ Wells, A. F. (1984), Structural Inorganic Chemistry (5th ed.), Oxford: Clarendon Press, ISBN 0-19-855370-6
- ↑ Holleman A. F., Wiberg E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5.
- ↑ Eric A. Betterton. Environmental Fate of Sodium Azide Derived from Automobile Airbags (англ.) // Critical Reviews in Environmental Science and Technology : journal. — 2003. — Vol. 33, no. 4. — P. 423—458. — doi:10.1080/10643380390245002.
- ↑ Kent R. Olson. Poisoning and Drug Overdose (англ.). — McGraw-Hill Education, 2007. — ISBN 0071443339.
- ↑ Lichstein, Herman C.; Malcolm H. Soule. Studies of the Effect of Sodium Azide on Microbic Growth and Respiration (англ.) // American Society for Microbiology[англ.] : journal. — 1943. — Vol. 47, no. 3. — P. 221—230.
- ↑ Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, Board on Chemical Sciences and Technology, Commission on Physical Sciences, Mathematics, and Applications, National Research Council. Prudent practices in the laboratory: handling and disposal of chemicals (англ.). — Washington, D.C.: National Academy Press[англ.], 1995. — ISBN 0309052297. Архивировано 25 марта 2015 года.
- ↑ Sodium Azide. Дата обращения: 2 ноября 2009. Архивировано 6 января 2010 года.
- ↑ Adam Smith, O'Ryan Johnson. Poisoning at Harvard – 6 lab workers sickened by coffee. The Boston Herald (25 октября 2009). Архивировано 10 апреля 2012 года.
- ↑ Adam Smith, Jessica Van Sack. Experts discount 'accident' theory in Harvard coffee poisoning. The Boston Herald (26 октября 2009). Архивировано 10 апреля 2012 года.