Никотинамидадениндинуклеоти́д — кофермент, имеющийся во всех живых клетках. NAD представляет собой динуклеотид и состоит из двух нуклеотидов, соединённых своими фосфатными группами. Один из нуклеотидов в качестве азотистого основания содержит аденин, другой — никотинамид.

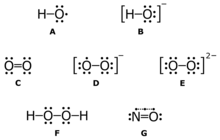
Супероксид — это ион молекулы кислорода с неспаренным электроном. Формула  . Относится к свободным радикалам, короткоживущий, способен спонтанно дисмутировать с водой в кислород и пероксид водорода. Обладает парамагнитными свойствами.
. Относится к свободным радикалам, короткоживущий, способен спонтанно дисмутировать с водой в кислород и пероксид водорода. Обладает парамагнитными свойствами.

Супероксиддисмутаза относится к группе антиоксидантных ферментов. Вместе с каталазой и другими антиоксидантными ферментами она защищает организм человека от постоянно образующихся высокотоксичных кислородных радикалов. Супероксиддисмутаза катализирует дисмутацию супероксида в кислород и пероксид водорода. Таким образом, она играет важнейшую роль в антиоксидантной защите практически всех клеток, так или иначе находящихся в контакте с кислородом. Одним из редких исключений является молочнокислая бактерия Lactobacillus plantarum и родственные ей молочнокислые бактерии, использующие иной механизм защиты от образующегося супероксида.
Окислительный стресс — процесс повреждения клетки в результате окисления.
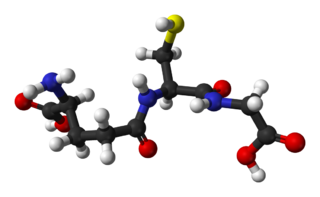
Глутатион — это трипептид γ-глутамилцистеинилглицин. Глутатион содержит необычную пептидную связь между аминогруппой цистеина и карбоксильной группой боковой цепи глутамата. Значение глутатиона в клетке определяется его антиоксидантными свойствами. Фактически глутатион не только защищает клетку от токсичных свободных радикалов, но и в целом определяет окислительно-восстановительные характеристики внутриклеточной среды.

Окисли́тельное фосфорили́рование — метаболический путь, при котором энергия, образовавшаяся при окислении питательных веществ, запасается в митохондриях клеток в виде АТФ. Хотя различные формы жизни на Земле используют разные питательные вещества, АТФ является универсальным соединением, в котором запасается энергия, необходимая для других метаболических процессов. Почти все аэробные организмы осуществляют окислительное фосфорилирование. Вероятно, широкому распространению этого метаболического пути способствовала его высокая энергетическая эффективность по сравнению с анаэробным брожением.

Липофусцин, также известный как «пигмент старения», — жёлто-коричневый аутофлюоресцирующий пигмент липидной и/или гликопротеиновой природы, накапливающийся в неделящихся клетках разных тканей и органов животных. В клетках содержится в основном в виде гранул, окруженных лизосомальной мембраной, сконцентрированных вокруг ядра.

Реактивные формы азота — токсичные побочные продукты метаболизма оксида азота, образуемого в организме с помощью NO-синтаз. Наряду с реактивными формами кислорода, РФА повреждают клетки. Вредное действие реактивных форм азота описывают словосочетанием «нитрозирующий стресс», по аналогии с «оксидативным стрессом».

Свободнорадикальная теория старения утверждает, что старение происходит из-за накопления повреждений в клетках, нанесённых свободными радикалами с течением времени.
p66Shc – белок, участвующий в регуляции клеточного уровня активных форм кислорода (АФК), индукции апоптоза и продолжительности жизни. Характерен исключительно для позвоночных животных: он присутствует, например, у шпорцевой лягушки и млекопитающих, но отсутствует у дрозофилы и нематоды.
SkQ — класс митохондриально-направленных антиоксидантов, разработанных под руководством академика Владимира Скулачёва.
Митохондриально-адресованные антиоксиданты — это антиоксиданты, накопление и действие которых происходит непосредственно в митохондриях. По одной из теории, митохондрии являются основными источниками активных форм кислорода в клетке. Поэтому, если удастся предотвратить окислительный стресс внутри митохондрий, активные формы кислорода не выйдут из митохондрий в цитоплазму клеток, и повреждения самой клетки не будут летальными.

8-оксо-2'-дезоксигуанозин (8-оксо-dG) — окисленное производное дезоксигуанозина. 8-оксо-dG является преобладающей формой свободнорадикального повреждения ДНК.

Митохондриа́льный ма́трикс или просто ма́трикс — ограниченное внутренней мембраной пространство, расположенное внутри митохондрий. Слово «матрикс» происходит из того, что эта среда является намного более вязкой по сравнению с более водянистой цитоплазмой. В состав матрикса входит множество веществ, включая ферменты, митохондриальную ДНК (кольцевая), рибосомы, малые органические молекулы, нуклеотидные коферменты и неорганические ионы. Ферменты матрикса содействуют реакциям биохимических процессов, в ходе которых синтезируется АТФ, таких как цикл трикарбоновых кислот, окислительное фосфорилирование, окисление пирувата и бета-окисление жирных кислот.
Стратегии достижения пренебрежимого старения инженерными методами — термин, введённый геронтологом Обри ди Греем для обозначения концепта для разработки медицинских регенеративных терапий, предназначенных для периодического исправления ущерба, наносимого возрастными изменениями. Основной целью комплекса терапий является достижение пренебрежимого старения за счёт ремонта происходящих в теле со временем повреждений, пока терапии повторяются пациентами.
Митофа́гия — селективное разрушение митохондрий путём аутофагии. Впервые этот термин был введён J. J. Lemasters в 2005 году, хотя ещё с 1962 года было известно о том, что лизосомы клеток печени содержат фрагменты митохондрий, а в 1977 году при изучении метаморфоза тутового шелкопряда было отмечено, что функциональные изменения митохондрий могут вызывать аутофагию. Митофагия необходима для поддержания жизнедеятельности клетки, она способствует кругообороту митохондрий и предотвращает накопление нефункциональных митохондрий, которые могут привести к дегенерации клетки. У дрожжей митофагия опосредуется белком Atg32, а у млекопитающих регуляция митофагии осуществляется белками PINK1 и паркином. Митофагия не приурочена только к повреждённым митохондриям, в ней могут участвовать и неповреждённые митохондрии.
Реакция сверхчувствительности — механизм, используемый растениями, чтобы предотвратить распространение инфекции, вызванной микробными патогенами. HR характеризуется быстрой гибелью клеток в локальной области вокруг инфекции. HR служит для ограничения роста и распространения возбудителей на другие части растения. HR является аналогом врождённого иммунитета у животных, и, как правило, предшествует более медленному системному ответу, что в итоге приводит к системной приобретённой устойчивости.
Программи́руемая кле́точная ги́бель, или программи́руемая кле́точная смерть, или запрограмми́рованная ги́бель кле́ток — гибель клетки, которая происходит за счёт запрограммированных внутриклеточных процессов. Ко второму десятилетию XXI века насчитывается более десяти известных видов программируемой клеточной гибели. С 2005 года классификацией видов клеточной гибели занимается Комитет по номенклатуре видов клеточной гибели. Программируемая клеточная гибель описана для всех крупных групп эукариот: животных, растений, грибов, слизевиков и даже одноклеточных организмов. ПКГ выполняет множество функций как на уровне клетки, так и на уровне целого организма: у животных она играет важнейшую роль в развитии, с её помощью элиминируются повреждённые клетки, у растений она задействована в образовании тканей, состоящих из мёртвых клеток, таких как ксилема. Программируемая клеточная гибель известна не только у эукариот: несколько видов программируемой гибели было описано у бактерий. Все виды программируемой клеточной гибели можно подразделить на внешние, которые запускаются сигналами извне клетки, и внутренние, вызванные нарушениями в функционировании клеток.
Прооксиданты — это химические вещества, вызывающие окислительный стресс посредством генерации активных форм кислорода, либо путем блокировки антиоксидантных систем. Окислительный стресс, индуцированный этими веществами, наносит ущерб клеткам и тканям. Например, передозировка парацетамолом может необратимо повредить печень отчасти из-за возникновения активных форм кислорода.
Повреждение клеток представляет собой различные изменения стресса, которым клетка подвергается из-за внешних, а также внутренних изменений окружающей среды. Среди других причин это может быть связано с физическими, химическими, инфекционными, биологическими, алиментарными или иммунологическими факторами. Повреждение клеток может быть обратимым или необратимым. В зависимости от степени повреждения клеточный ответ может быть адаптивным, и, по возможности, гомеостаз восстанавливается. Гибель клеток происходит, когда тяжесть повреждения превышает способность клетки к самовосстановлению. Гибель клеток зависит как от продолжительности воздействия вредного стимула, так и от тяжести причинённого ущерба. Гибель клеток может происходить путём некроза или апоптоза.