
Ферме́нты, или энзи́мы , — обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам: АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу.
Глико́лиз, или путь Эмбдена — Мейергофа — Парнаса — процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты. Гликолиз состоит из цепи последовательных ферментативных реакций и сопровождается запасанием энергии в форме АТФ и НАДH. Гликолиз является универсальным путём катаболизма глюкозы и одним из трёх путей окисления глюкозы, встречающихся в живых клетках. Реакция гликолиза в суммарном виде выглядит следующим образом:
- Глюкоза + 2НАД+ + 2АДФ + 2Pi → 2 пируват + 2НАД*H + 2Н+ + 2АТФ + 2Н2O.

Ци́кл трикарбо́новых кисло́т (сокр. ЦТК, цикл Кре́бса, цитра́тный цикл, цикл лимо́нной кислоты́) — центральная часть общего пути катаболизма, циклический биохимический процесс, в ходе которого ацетильные остатки (СН3СО-) окисляются до диоксида углерода (CO2). При этом за один цикл образуется 2 молекулы CO2, 3 НАДН, 1 ФАДH2 и 1 ГТФ (или АТФ). Электроны, находящиеся на НАДН и ФАДH2, в дальнейшем переносятся на дыхательную цепь, где в ходе реакций окислительного фосфорилирования образуется АТФ.

Субстра́т в биохимии — исходное вещество, преобразуемое ферментом в результате специфического фермент-субстратного взаимодействия в один или несколько конечных продуктов. После окончания катализа и высвобождения продукта реакции активный центр фермента снова становится вакантным и может связывать другие молекулы субстрата.
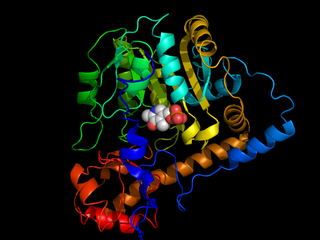
Аминотрансфера́зы (трансаминазы) — ферменты из группы трансфераз, катализирующие перенос аминогрупп от аминокислот на кетокислоты без образования свободного аммиака. Эти реакции трансаминирования осуществляют связь между белковым и углеводным обменом. Аминотрансферазы также называют трансаминазами, а реакцию — трансаминированием. Ферменты относятся к подклассу КФ 2.6.

В биологии активный центр — это область фермента, где молекулы субстрата связываются и подвергаются химической реакции. Активный центр состоит из аминокислотных остатков, которые образуют временные связи с субстратом, и остатков, которые катализируют реакцию этого субстрата. Хотя активный центр занимает только ~ 10-20 % от объёма фермента он является наиболее важной частью, поскольку он непосредственно катализирует химическую реакцию. Обычно активный центр состоит из трех-четырех аминокислот, в то время как другие аминокислоты в белке необходимы для поддержания его третичной структуры.
Лиа́зы (КФ4) — отдельный класс ферментов, катализирующих реакции негидролитического и неокислительного разрыва различных химических связей субстрата, обратимые реакции образования и разрыва двойных связей, сопровождающиеся отщеплением или присоединением групп атомов по её месту, а также образованием циклических структур.

Уравне́ние Михаэ́лиса — Ме́нтен — уравнение наиболее известной модели ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата при определённых общепринятых допущениях. Уравнение названо в честь физикохимиков Леонора Михаэлиса и Мод Леоноры Ментен, опубликовавших в 1913 году статью, в которой они провели математический анализ ферментативной кинетики. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:


Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Оксидоредукта́зы (КФ1) — отдельный класс ферментов, катализирующих лежащие в основе биологического окисления реакции, сопровождающиеся переносом электронов с одной молекулы на другую.
Шифр КФ, или код фермента, англ. EC number — классификационный номер фермента по международной иерархической классификации. Принятая система классифицирует ферменты по группам и индексирует индивидуальные ферменты, что важно для стандартизации исследований.
Протеа́зы, протеиназы, протеолитические ферменты — ферменты из класса гидролаз, которые расщепляют пептидную связь —СО—NH— между аминокислотами в белках. Делятся на две группы:
- экзопротеазы — выделяются организмом во внешнюю среду ;
- эндопротеазы — находятся внутри клеток.

Катехол-О-метилтрансфераза — фермент, играющий важную роль в распаде катехоламинов, в том числе дофамина, адреналина, норадреналина, так как присутствует диффузно во всех тканях. COMT катализирует присоединение к катехоламину метильной группы, донором которой служит S-аденозилметионин. Фермент был открыт Джулиусом Аксельродом в 1958 году.
Гликозилтрансферазы — ферменты, переносящие остатки моносахаридов от углевода-донора на молекулу-акцептор, чаще всего спирт.
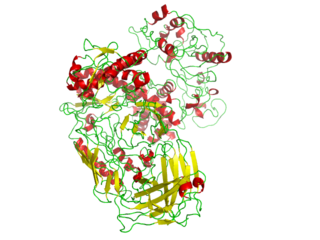
Полимера́за — фермент, главной биологической функцией которого является синтез полимеров нуклеиновых кислот. ДНК-полимераза и РНК-полимераза синтезируют молекулы ДНК и РНК соответственно, в основном, путём комплементарного копирования родительских цепей ДНК или РНК.
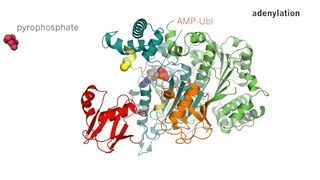
Ферментативный катализ — это увеличение скорости процесса с помощью биологической молекулы, «фермента». Большинство ферментов представляют собой белки, и большинство таких процессов представляют собой химические реакции. Внутри фермента катализ обычно происходит в локализованном центре, называемом активным центром.

Ферментати́вная кине́тика — зависимость скорости химической реакции от её условий — раздел биохимии, предметом которого являются химические реакции, катализируемые ферментами, изучающий закономерности течения во времени и механизм ферментативных реакций. Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагентов, количественным изучением эффектов варьирования условий (кинетики) той или иной химической реакции, а также измеряет её скорость. Изучение ферментов позволяет выявить каталитический механизм действия определённого фермента и контролировать его роль в процессе обмена веществ, способного замедлять (ингибировать) или ускорять (активировать) ход химической реакции. Таким образом, кинетические исследования позволяют не только определить сродство и специфичность связывания субстратов и ингибиторов к ферментам, но и найти максимальную скорость процесса, катализируемого специфическим ферментом, а также попутно решить многие другие задачи и возникающие проблемы. При этом, основная часть проблем ферментативной кинетики сводится к:
- анализу предполагаемых схем ферментативных реакций,
- выводу уравнений скорости, соответствующих этим схемам,
- сопоставлению полученных зависимостей с данными эксперимента.
Транслоказы — отдельный класс ферментов, катализирующих перенос ионов или молекул через мембраны или их разделение в мембранах. Этот класс ферментов сформировался из ранее принадлежащих другим классам ферментов.

OGT — ген, кодирующий гликозилтрансферазу OGT. Фермент OGT гликозилирует белки, катализируя образование O-гликозидной связи между N-ацетилглюкозамином (GlcNAc) и остатками серина или треонина. В качестве источника GlcNAc-группы фермент OGT использует УДФ-N-ацетилглюкозамин. Среди мишеней фермента OGT — множество различных белков, включая метилтрансферазу MLL5, гистон H2B, тау-белок, корегулятор транскрипции HCFC1, киназы AKT1 и PFKL. Для гена OGT обнаружены альтернативно сплайсированные варианты транскриптов, кодирующие различные изоформы фермента. Одна из изоформ белка OGT локализуется в митохондрии, а две других — в цитоплазме и ядре клетки. У человека ген OGT находится на длинном плече X-хромосомы (Xq13); описано несколько точечных мутаций в гене OGT, которые связывают со слабоумием и задержкой развития. Аминокислотная последовательность белка, кодируемого геном OGT, является высококонсервативной в филогенетическом ряду от червей до человека. Нокаут гена OGT у млекопитающих является эмбриолетальным.
 Фосфорибозилпирофосфат
Фосфорибозилпирофосфат 5-фосфорибозиламин
5-фосфорибозиламин










