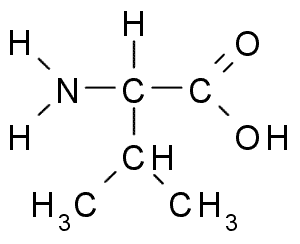
Аминокислоты

Аминокисло́ты, также аминокарбо́новые кисло́ты, АМК — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O) и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 21 используется в генетическом коде).[1] Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История
Большинство из около 500 известных аминокислот было открыто после 1953 года, в том числе во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречаются в природе в свободном виде, а остальные — только как промежуточные элементы обмена веществ[1].
Жирным шрифтом выделены незаменимые аминокислоты.
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl · NH2 —CH2 —COOH (Хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
При определенных условиях могут быть заряжены все три ионогенные группы (например у гистидина), тогда они образуют двойные соли [6]. Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе [6].
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и только они включаются в состав белков, синтезируемых на рибосомах.
D-аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[7], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счёт образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты[8].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем — и в тканях высших организмов[9]. Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[10].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин[11].
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O)[12][13]. Это так называемые 21-я и 22-я аминокислоты[14].
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[15]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:

Классификация
| Аминокислота | 3-буквы[16] | 1-буква[16] | Генетический код | Мнемоническое правило[17] | Полярность[18] | Класс по радикалу | Mr | Vw (Å3) | pI | Гидрофобность[19] | Частота в белках (%)[20] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75,067 | 48 | 6,06 | −0,4 | 7,03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89,094 | 67 | 6,01 | 1,8 | 8,76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117,148 | 105 | 6,00 | 4,2 | 6,73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131,175 | 124 | 6,05 | 4,5 | 5,49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131,175 | 124 | 6,01 | 3,8 | 9,68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6,30 | −1,6 | 5,02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105,093 | 73 | 5,68 | −0,8 | 7,14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119,119 | 93 | 5,60 | −0,7 | 5,53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Полярные | Серосодержащие | 121,154 | 86 | 5,05 | 2,5 | 1,38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149,208 | 124 | 5,74 | 1,9 | 2,32 |
| Аспарагиновая | Asp | D | GAU, GAC | asparDic acid | Полярные | заряженные отрицательно | 133,104 | 91 | 2,85 | −3,5 | 5,49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132,119 | 96 | 5,41 | −3,5 | 3,93 |
| Глутаминовая | Glu | E | GAA, GAG | gluEtamic acid | Полярные | заряженные отрицательно | 147,131 | 109 | 3,15 | −3,5 | 6,32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146,146 | 114 | 5,65 | −3,5 | 3,9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146,189 | 135 | 9,60 | −3,9 | 5,19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10,76 | −4,5 | 5,78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные заряженные положительно | Гетероциклические | 155,156 | 118 | 7,60 | −3,2 | 2,26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165,192 | 135 | 5,49 | 2,8 | 3,87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181,191 | 141 | 5,64 | −1,3 | 2,91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические, Гетероциклические | 204,228 | 163 | 5,89 | −0,9 | 6,73 |
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[18]
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан,
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
- Глюкогенные — при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат
- Кетогенные — распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды
- Глюко-кетогенные — при распаде образуются метаболиты обоих типов
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также называют аминокислотами:[]
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта[21].
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты[22].
Примечания
- ↑ 1 2 Wagner I., Musso H. New Naturally Occurring Amino Acids (нем.) // Angewandte Chemie International Edition in English : magazin. — 1983. — November (Bd. 22, Nr. 11). — S. 816—828. — doi:10.1002/anie.198308161.
- ↑ S. Hansen. Entdeckung der Aminosäuren. — 2015. Архивировано 15 июня 2016 года.
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ 1 2 Ernst Schulze (chemist) (англ.) // Wikipedia. — 2019-02-14.
- ↑ Карпов В. Л. От чего зависит судьба гена // Природа. — Наука, 2005. — № 3. — С. 34—43. Архивировано 10 февраля 2018 года.
- ↑ 1 2 Anton P. Novikov, Alexey V. Safonov, Konstantin E. German, Mikhail S. Grigoriev. What kind of interactions we may get moving from zwitter to “dritter” ions: C–O⋯Re(O4) and Re–O⋯Re(O4) anion⋯anion interactions make structural difference between L-histidinium perrhenate and pertechnetate (англ.) // CrystEngComm. — 2023-12-01. — ISSN 1466-8033. — doi:10.1039/D3CE01164J. Архивировано 8 декабря 2023 года.
- ↑ Helfman, P M; J L Bada. Aspartic acid racemization in tooth enamel from living humans (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1975. — Vol. 72, no. 8. — P. 2891—2894. Архивировано 4 сентября 2017 года.
- ↑ CLOOS P; FLEDELIUS C.: Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (1 февраля 2000). Дата обращения: 5 сентября 2011. Архивировано 2 февраля 2012 года.
- ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R—36R. — ISSN 0959-6658. Архивировано 20 августа 2018 года.
- ↑ Herman Wolosker, Elena Dumin, Livia Balan, Veronika N. Foltyn. D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration // The FEBS journal. — 2008-7. — Т. 275, вып. 14. — С. 3514—3526. — ISSN 1742-464X. — doi:10.1111/j.1742-4658.2008.06515.x. Архивировано 15 сентября 2018 года.
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317—327. — ISSN 0950-382X. Архивировано 20 августа 2018 года.
- ↑ Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins—properties and biotechnological use // Biochimica et Biophysica Acta (BBA) - General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1—13. — ISSN 0304-4165. — doi:10.1016/j.bbagen.2005.05.010. Архивировано 5 июля 2018 года.
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706—712. — ISSN 1369-5274. — doi:10.1016/j.mib.2005.10.009. Архивировано 20 августа 2018 года.
- ↑ Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29—35. — ISSN 1552-4450. — doi:10.1038/nchembio847. Архивировано 20 августа 2018 года.
- ↑ Andrei S. Rodin, Eörs Szathmáry, Sergei N. Rodin. On origin of genetic code and tRNA before translation // Biology Direct. — 2011-02-22. — Т. 6. — С. 14. — ISSN 1745-6150. — doi:10.1186/1745-6150-6-14. Архивировано 15 июня 2018 года.
- ↑ 1 2 Cooper, Geoffrey M. The cell : a molecular approach. — 3rd ed. — Washington, D.C.: ASM Press, 2004. — xx, 713 pages с. — ISBN 0878932143, 9780878932146, 0878930760, 9780878930760.
- ↑ Р. Б. Соловьев, учитель биологии. Несколько мнемонических правил Архивная копия от 18 апреля 2018 на Wayback Machine
- ↑ 1 2 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- ↑ J. Kyte, R. F. Doolittle. A simple method for displaying the hydropathic character of a protein // Journal of Molecular Biology. — 1982-05-05. — Т. 157, вып. 1. — С. 105—132. — ISSN 0022-2836. Архивировано 6 июля 2018 года.
- ↑ Lukasz P. Kozlowski. Proteome-pI: proteome isoelectric point database // Nucleic Acids Research. — 2017-01-04. — Т. 45, вып. D1. — С. D1112—D1116. — ISSN 1362-4962. — doi:10.1093/nar/gkw978. Архивировано 2 июля 2018 года.
- ↑ Fumio Sanda, Takeshi Endo. Syntheses and functions of polymers based on amino acids (англ.) // Macromolecular Chemistry and Physics. — Vol. 200, iss. 12. — ISSN 1521-3935. — doi:10.1002/(sici)1521-3935(19991201)200:12%3C2651::aid-macp2651%3E3.0.co;2-p.
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
Литература
- Аминокислоты : [арх. 3 января 2023] / Липкин В. М., Родионов И. Л. // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
- Збарский И. Б., Симакова Р. А., Будковская Н. Г. Аминокислоты // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1974. — Т. 1 : А — Антибиоз. — 576 с. : ил.
- Эксперименты Миллера-Юри и обсуждения:
- Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
- Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
- Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с.
- Аминокислоты, пептиды, белки. Под ред. Ю. В. Митина
- Аминокислоты // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.