Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс и другие комплексы.

Никоти́н — высокотоксичный алкалоид пиридинового ряда, содержащийся в растениях семейства паслёновых (Solanaceae), преимущественно в листьях и стеблях табака, махорки (2—14 %), в меньших количествах — в томатах, картофеле, баклажанах, зелёном перце. Никотиновые алкалоиды также присутствуют в листьях коки. Биосинтез никотина происходит в корнях, а его накопление — в листьях. Никотин является токсичным для некоторых насекомых; вследствие этого никотин раньше широко использовался как инсектицид, а в настоящее время в том же качестве продолжают использоваться синтетические аналоги никотина — так называемые неоникотиноиды. Ввиду инсектицидных свойств никотина мелко измельчённый табачный лист и сейчас широко применяют как инсектицид.

Никотинамидадениндинуклеоти́д — кофермент, имеющийся во всех живых клетках. NAD представляет собой динуклеотид и состоит из двух нуклеотидов, соединённых своими фосфатными группами. Один из нуклеотидов в качестве азотистого основания содержит аденин, другой — никотинамид.
Метаногенез, биосинтез метана — процесс образования метана анаэробными археями, сопряжённый с получением ими энергии. Существует три типа метаногенеза:
- Восстановление одноуглеродных соединений с помощью молекулярного водорода или двух- и более углеродных спиртов.
- Диспропорционирование одноуглеродных соединений.
- Диспропорционирование ацетата.

Диметилтриптамин (DMT) или N,N-диметилтриптамин — эндогенный психоделик, в нервной системе человека выполняет функцию агониста 5-HT2A серотониновых рецепторов, также алкалоид многих растений, сильнодействующее психоактивное вещество из класса триптаминов. По химической структуре DMT схож с серотонином — одним из важных нейромедиаторов головного мозга млекопитающих. Он также вырабатывается в небольших количествах человеческим организмом в процессе нормального метаболизма.

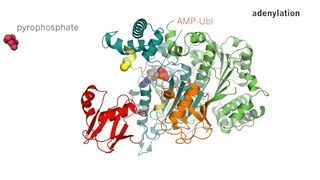
Протеасо́ма — многобелковый комплекс, разрушающий ненужные или дефектные белки при помощи протеолиза до коротких пептидов. Эти пептиды затем могут быть расщеплены до отдельных аминокислот. Протеасомы присутствуют в клетках эукариот, архей и некоторых бактерий. В эукариотических клетках протеасомы содержатся и в ядре, и в цитоплазме. Деградация 80—90 % внутриклеточных белков происходит при участии протеасомы. Для того чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитинлигазами. Присоединение первой молекулы убиквитина к белку служит для убиквитинлигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени. В целом вся эта система получила название убиквитин-зависимой деградации белка.

Убиквити́н — небольшой консервативный белок эукариот, участвующий в регуляции процессов внутриклеточной деградации других белков, а также в модификации их функций. Он присутствует почти во всех тканях многоклеточных эукариот, а также у одноклеточных эукариотических организмов. Убиквитин был открыт в 1975 году Гидеоном Голдштейном с соавторами и охарактеризован в 70—80-х годах XX века. В геноме человека есть четыре гена, кодирующих убиквитин: UBB, UBC, UBA52 и RPS27A.

Система рестрикции-модификации — ферментативная система бактерий, разрушающая попавшую в клетку чужеродную ДНК. Основная её функция — защита клетки от чужеродного генетического материала, например, бактериофагов и плазмид. Для компонентов системы характерны два типа активности — метилтрансферазная (метилазная) и эндонуклеазная. За каждую из них могут отвечать как отдельные белки, так и один белок, сочетающий в себе обе функции.
Протеинкина́зы — подкласс ферментов киназ (фосфотрансфераз). Протеинкиназы модифицируют другие белки путём фосфорилирования остатков аминокислот, имеющих гидроксильные группы или гетероциклической аминогруппы гистидина.

Убиквитинлигаза — фермент-лигаза, ковалентно присоединяющий убиквитин к белку-мишени изопептидной связью. Убиквитинлигазы являются частью системы убиквитинопосредованного распада белка в протеасомах. Известно, что протеасома расщепляет не любые белки, а только те, которые были «помечены» убиквитином. Убиквитинлигазы специфично узнают белки-субстраты и участвуют в их полиубиквитинировании, которое, в конечном счёте, приводит к деградации последних в протеасомах. Кроме этого, убиквитинлигазы осуществляют и другие модификации белков убиквитином, такие как моноубиквитинирование и мультиубиквитинирование, которые имеют регуляторное значение. В геноме человека обнаружено более 500 генов убиквитинлигаз.

ADAM10 — фермент металлопротеаза, относящийся к семейству металлопротеаз ADAM. Играет важную роль в развитии, воспалении, нейропротекции и онкологических заболеваниях. По ферментативной специфичности близка к другой металлопротеазе ADAM17.

Протеолиз — процесс гидролиза белков, катализируемый ферментами пептидгидролазами, или протеазами.

Кэп, 5'-кэп, или кэп-структура — структура на 5'-конце матричных РНК (мРНК) и некоторых других РНК эукариот. Кэп состоит из одного или нескольких модифицированных нуклеотидов и характерен только для транскриптов, синтезируемых РНК-полимеразой II. Наличие кэпа — один из признаков, отличающих эукариотические мРНК от прокариотических, которые несут трифосфат на 5'-конце. Это и другие отличия обуславливают существенно более высокую стабильность, особый механизм инициации трансляции и другие особенности жизненного цикла эукариотической мРНК.
Ферментативный катализ — это увеличение скорости процесса с помощью биологической молекулы, «фермента». Большинство ферментов представляют собой белки, и большинство таких процессов представляют собой химические реакции. Внутри фермента катализ обычно происходит в локализованном центре, называемом активным центром.

ADAM8 — фермент металлопротеаза, относящийся к семейству металлопротеаз ADAM. Продукт гена человека ADAM8.

Лакказа — фермент, относящийся к оксидазам. Катализирует ряд реакций окисления ароматических и неароматических соединений. Содержит медь, связанную имидазольными группами гистидина. Встречается во многих микроорганизмах, грибах, растениях. Лакказы из различных организмов могут существенно отличаться по своим свойствам.
Суперсемейство белков — это наиболее крупная единица группировки белков, для которых может быть предположено наличие общего эволюционного предка. Обычно суперсемейство объединяется по принципу сходства вторичных и третичных структур белков, входящих в него и по принципу сходства механизма действия белков, несмотря на то, что сходства аминокислотных последовательностей в пределах суперсемейства может не наблюдаться и чаще всего не наблюдается. Суперсемейства обычно содержат несколько семейств белков, которые проявляют сходство аминокислотных последовательностей внутри семейств, но не между семействами. Термин «клан белков» часто применяется по отношению к суперсемействам протеаз, на основании классификации MEROPS.
Протеаза TEV — высокоспецифичная цистеиновая протеаза вируса гравировки табака. Относится к суперсемейству PA из химотрипсин-подобных протеаз. Благодаря своей высокой специфичности к последовательности часто используется для контролируемого расщепления гибридных белков in vitro и in vivo.

В биохимии аллостерическая регуляция — это регуляция фермента путем связывания эффекторной молекулы в сайте, отличном от активного сайта фермента.
Ферментный промискуитет (неразборчивость) — это способность фермента катализировать случайную побочную реакцию в дополнение к своей основной реакции. Хотя ферменты являются чрезвычайно специфическими катализаторами, они часто могут выполнять побочные реакции в дополнение к своей основной природной каталитической активности. Побочная активность фермента обычно протекает медленнее по сравнению с основной деятельностью и находится под нейтральным отбором. Несмотря на то, что обычно эти активности физиологически нерелевантны, в условиях нового избирательного давления эти виды деятельности могут принести пользу, тем самым побуждая эволюцию ранее побочных активностей стать новым основным видом деятельности. Примером этого является хлоргидролаза атразина (кодируется atzA) Pseudomonas sр., произошедшая из меламиндезаминазы, которая имеет очень небольшую побочную активность в отношении атразина, химического вещества, созданного руками человека.