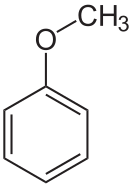
Анизол
| Анизол | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | Метоксибензол, метилфениловый эфир | ||
| Традиционные названия | Анизол | ||
| Хим. формула | C7H8O | ||
| Рац. формула | C6H5OCH3 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 108,13 г/моль | ||
| Плотность | 0,9954 г/см³ | ||
| Поверхностное натяжение | 35,1 мН/м[3], 32,09 мН/м[3] и 29,08 мН/м[3] | ||
| Динамическая вязкость | 1,42 мПа·с[2], 1,056 мПа·с[4], 0,747 мПа·с[4], 0,554 мПа·с[4] и 0,427 мПа·с[4] | ||
| Энергия ионизации | 8,21 эВ[5] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -37,5 °C | ||
| • кипения | 153,8 °C | ||
| • вспышки | 41 °C °C | ||
| • самовоспламенения | 475 °C[1][2] | ||
| Пределы взрываемости | 1,2 об.%[2] | ||
| Критическая точка | 4,04 МПа, 369 °C | ||
| Давление пара | 3,2 гПа[2], 4,72 гПа[2][1], 13,3 гПа[2] и 53,1 гПа[2] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,15 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,5178 | ||
| Структура | |||
| Дипольный момент | 1,38 ± 0,07 Д[6] | ||
| Классификация | |||
| Рег. номер CAS | 100-66-3 | ||
| PubChem | 7519 | ||
| Рег. номер EINECS | 202-876-1 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 16579 | ||
| ChemSpider | 7238 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Анизо́л (метоксибензол, метилфениловый эфир) C6H5OCH3 — метиловый эфир фенола, органическое вещество, относится к простым эфирам.
Получение
В промышленности анизол получают взаимодействием фенолята натрия с метилсульфатом натрия:
Взаимодействием фенола и метанола:
Также можно получить анизол при взаимодействии фенолята натрия с хлористым метилом[7]:
В лабораторных условиях анизол получают взаимодействием фенола и диметилсульфата в водно-щелочной среде:
Физические свойства
Анизол — бесцветная жидкость с приятным запахом. Легко растворим в этаноле, диэтиловом эфире, бензоле. Плохо растворим в воде (0,15 г/100 г воды).
Химические свойства
- Анизол, как и все простые эфиры, устойчив и гидролизуется только при особых условиях:
- При действии хлора на анизол образуется смесь 4-хлор- (пара-), 2,4-дихлор- и 2,4,6-трихлоранизолов.
- При хлорировании с помощью PCl5 образуется только 4-хлоранизол.
Применение
Анизол используется как растворитель и как промежуточный продукт в производстве красителей, лекарств и душистых веществ.
Токсические свойства
Слаботоксичен, ЛД50 3,5÷4 г/кг (крысы, подкожно) и 10 г/кг (крысы, внутрижелудочно). Оказывает очень слабое раздражение кожи[7].
Безопасность
Температура вспышки анизола 41 °C, температура самовоспламенения 485 °C, КПВ 0,34÷6,3%.
Литература
- Анизол // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
См. также
Примечания
- ↑ 1 2 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 16—17. — ISBN 978-1-4987-5428-6
- ↑ 1 2 3 4 5 6 7 GESTIS database
- ↑ 1 2 3 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 6—190. — ISBN 978-1-4987-5428-6
- ↑ 1 2 3 4 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 6—243. — ISBN 978-1-4987-5428-6
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 9—60. — ISBN 978-1-4987-5428-6
- ↑ 1 2 Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Изд. 7-е, пер. и доп. В трех томах. Том I. Органические вещества. Под ред. засл. деят. науки проф. Н. В. Лазарева и докт. мед. наук Э. Н. Левиной. Л., «Химия», 1976. 592 стр., 27 табл., библиография —1850 названий.