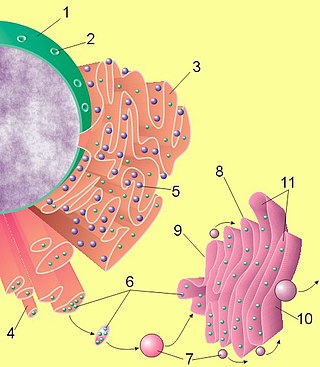
Аппарат Гольджи


Аппара́т (ко́мплекс) Го́льджи — мембранная структура эукариотической клетки, органелла, в основном предназначенная для выведения веществ, синтезированных в эндоплазматическом ретикулуме. Аппарат Гольджи назван в честь итальянского учёного Камилло Гольджи, впервые обнаружившего его в 1898 году[1].
Строение
Комплекс Гольджи представляет собой стопку дискообразных мембранных мешочков (цистерн), несколько расширенных ближе к краям, и связанную с ними систему пузырьков Гольджи. В растительных клетках обнаруживается ряд отдельных стопок (диктиосомы), в животных клетках часто содержится одна большая или несколько соединённых трубками стопок.
В комплексе Гольджи выделяют 3 отдела цистерн, окружённых мембранными пузырьками:
- Цис-отдел (ближний к ядру);
- Медиальный отдел;
- Транс-отдел (самый отдалённый от ядра).
Эти отделы различаются между собой набором ферментов. В цис-отделе первую цистерну называют «цистерной спасения», так как с её помощью рецепторы, поступающие из промежуточной эндоплазматической сети, возвращаются обратно. Фермент цис-отдела: фосфогликозидаза (присоединяет фосфат к углеводу — маннозе). В медиальном отделе находится 2 фермента: манназидаза (отщепляет маннозу) и N-ацетилглюкозаминтрансфераза (присоединяет определённые углеводы — гликозамины). В транс-отделе находятся ферменты пептидаза (осуществляет протеолиз) и трансфераза (осуществляет переброс химических групп).
Функции

Аппарат Гольджи является основной станцией сбора и отправки белковых продуктов, получаемых из эндоплазматического ретикулума (ЭПР). Белки, синтезируемые в ЭПР, переносятся в аппарат Гольджи внутри везикул и сливаются с его мембранами. После обработки аппаратом Гольджи белки в везикулах направляются к месту назначения внутри клетки или выделяются во внешнюю среду посредством экзоцитоза. В этом отношении аппарат Гольджи можно сравнить с почтовым отделением: он упаковывает и маркирует белки, которые затем отправляет в разные части клетки или во внеклеточный матрикс. Аппарат Гольджи также участвует в транспорте липидов и формировании лизосом[2].
Структура и функции аппарата Гольджи тесно связаны между собой. Отдельные цистерны содержат различные наборы ферментов, обеспечивая прогрессивную обработку транспортируемых белков по мере их перемещения к транс-отделу[3][4]. Ферментативные реакции внутри цистерн аппарата Гольджи происходят исключительно возле их мембранных поверхностей, где закрепляются ферменты. Это контрастирует с ферментативными реакциями в ЭПР, где растворимые белки и ферменты содержатся в просвете. Большая часть ферментативной обработки представляет собой посттрансляционную модификацию белков. Например, фосфорилирование олигосахаридов на лизосомальных белках происходит в начале цис-сети[3]. Цис-цистерны связаны с удалением остатков маннозы[3][4]. Удаление остатков маннозы и добавление N-ацетилглюкозамина происходит в медиальных цистернах. В транс-цистернах происходит присоединение галактозы и сиаловой кислоты. Сульфатирование тирозинов и углеводов происходит в пределах транс-сети[3]. Другие общие посттрансляционные модификации белков включают добавление углеводов (гликозилирование)[5] и фосфатов (фосфорилирование). Модификации белка могут образовывать сигнальную последовательность, определяющую конечное назначение белка. Например, аппарат Гольджи добавляет маннозо-6-фосфатную[англ.] метку к белкам, предназначенным для лизосом. Другая важная функция аппарата Гольджи заключается в образовании протеогликанов. Ферменты Гольджи присоединяют белки к гликозаминогликанам, создавая таким образом протеогликаны[6]. Гликозаминогликаны представляют собой длинные неразветвлённые полисахариды, присутствующие во внеклеточном матриксе животных[7].
Транспорт веществ из эндоплазматической сети
Аппарат Гольджи асимметричен — цистерны, располагающиеся ближе к ядру клетки (цис-Гольджи), содержат наименее зрелые белки. К этим цистернам непрерывно присоединяются мембранные пузырьки — везикулы, отпочковывающиеся от гранулярного эндоплазматического ретикулума (ЭПР), на мембранах которого и происходит синтез белков рибосомами. Перемещение белков из эндоплазматической сети (ЭПС) в аппарат Гольджи происходит неизбирательно, однако не полностью или неправильно свернутые белки остаются при этом в эндоплазматической сети. Возвращение белков из аппарата Гольджи в ЭПС требует наличия специфической сигнальной последовательности (лизин-аспарагин-глутамин-лейцин) и происходит благодаря связыванию этих белков с мембранными рецепторами в цис-Гольджи.
Модификация белков в аппарате Гольджи
В цистернах аппарата Гольджи созревают белки, предназначенные для секреции, трансмембранные белки плазматической мембраны, белки лизосом и т. д. Созревающие белки последовательно перемещаются по цистернам в органеллы, в которых происходят их модификации — гликозилирование и фосфорилирование. При О-гликозилировании к белкам присоединяются сложные сахара через атом кислорода. При фосфорилировании происходит присоединение к белкам остатка ортофосфорной кислоты.

Разные цистерны аппарата Гольджи содержат разные резидентные каталитические ферменты и, следовательно, с созревающими белками в них последовательно происходят разные процессы. Понятно, что такой ступенчатый процесс должен как-то контролироваться. Действительно, созревающие белки «маркируются» специальными полисахаридными остатками (преимущественно маннозными), по-видимому, играющими роль своеобразного «знака качества».
Не до конца понятно, каким образом созревающие белки перемещаются по цистернам аппарата Гольджи, в то время как резидентные белки остаются в большей или меньшей степени ассоциированы с одной цистерной. Существуют две взаимонеисключающие гипотезы, объясняющие этот механизм:
- согласно первой, транспорт белков осуществляется при помощи таких же механизмов везикулярного транспорта, как и путь транспорта из ЭПР, причём резидентные белки не включаются в отпочковывающуюся везикулу;
- согласно второй, происходит непрерывное передвижение (созревание) самих цистерн, их сборка из пузырьков с одного конца и разборка с другого конца органеллы, а резидентные белки перемещаются ретроградно (в обратном направлении) при помощи везикулярного транспорта.
Транспорт белков из аппарата Гольджи
В конце концов от транс-Гольджи отпочковываются пузырьки, содержащие полностью зрелые белки. Главная функция аппарата Гольджи — сортировка проходящих через него белков. В аппарате Гольджи происходит формирование «трехнаправленного белкового потока»:
- созревание и транспорт белков плазматической мембраны;
- созревание и транспорт секретов;
- созревание и транспорт ферментов лизосом.
С помощью везикулярного транспорта прошедшие через аппарат Гольджи белки доставляются «по адресу» в зависимости от полученных ими в аппарате Гольджи «меток». Механизмы этого процесса также не до конца понятны. Известно, что транспорт белков из аппарата Гольджи требует участия специфических мембранных рецепторов, которые опознают «груз» и обеспечивают избирательную стыковку пузырька с той или иной органеллой.
Образование лизосом
Многие гидролитические ферменты лизосом проходят через аппарат Гольджи, где они получают «метку» в виде специфического сахара — маннозо-6-фосфата (М6Ф) — в составе присоединённого к аминокислотной цепочке олигосахарида. Добавление этой метки происходит при участии двух ферментов. Фермент N-ацетилглюкозаминфосфотрансфераза специфически опознает лизосомальные гидролазы по деталям их третичной структуры и присоединяет N-ацетилглюкозаминфосфат к шестому атому нескольких маннозных остатков олигосахарида гидролазы. Второй фермент — фосфогликозидаза — отщепляет N-ацетилглюкозамин, создавая М6Ф-метку. Затем эта метка опознается белком-рецептором М6Ф, с его помощью гидролазы упаковываются в везикулы и доставляются в лизосомы. Там, в кислой среде, фосфат отщепляется от зрелой гидролазы. При нарушении работы N-ацетилглюкозаминфосфотрансферазы из-за мутаций или при генетических дефектах рецептора М6Ф все ферменты лизосом «по умолчанию» доставляются к наружной мембране и секретируются во внеклеточную среду. Выяснилось, что в норме некоторое количество рецепторов М6Ф также попадают на наружную мембрану. Они возвращают случайно попавшие во внешнюю среду ферменты лизосом внутрь клетки в процессе эндоцитоза.
Транспорт белков на наружную мембрану
Как правило, ещё в ходе синтеза белки наружной мембраны встраиваются своими гидрофобными участками в мембрану эндоплазматической сети. Затем в составе мембраны везикул они доставляются в аппарат Гольджи, а оттуда — к поверхности клетки. При слиянии везикулы с плазмалеммой такие белки остаются в её составе, а не выделяются во внешнюю среду, как те белки, что находились в полости везикулы.
Секреция
Практически все секретируемые клеткой вещества (как белковой, так и небелковой природы) проходят через аппарат Гольджи и там упаковываются в секреторные пузырьки. Так, у растений при участии диктиосом секретируется материал клеточной стенки.
Примечания
- ↑ Fabene P.F., Bentivoglio M. 1898–1998: Camillo Golgi and "the Golgi": one hundred years of terminological clones (англ.) // Brain Res. Bull.[англ.] : journal. — 1998. — October (vol. 47, no. 3). — P. 195—198. — doi:10.1016/S0361-9230(98)00079-3. — PMID 9865849.
- ↑ Campbell N. A. Biology (4 ed.) (англ.). — Menlo Park, CA: Benjamin/Cummings, 1996. — P. 122, 123. — ISBN 978-0-8053-1957-6.
- ↑ 1 2 3 4 Alberts B., et al. Molecular Biology of the Cell (англ.). — Garland Publishing, 1994. — ISBN 978-0-8153-1619-0.
- ↑ 1 2 Day K. J., L. Staehelin A., Glick B. S. A three-stage model of Golgi structure and function (англ.) // Histochemistry and Cell Biology : journal. — 2013. — Vol. 140, iss. 3. — P. 239—249. — ISSN 1432-119X. — doi:10.1007/s00418-013-1128-3. — PMID 23881164. Архивировано 4 августа 2023 года.
- ↑ Elmouelhi N., Yarema K. J. Building on What Nature Gave Us: Engineering Cell Glycosylation Pathways (англ.) // Biotechnology and Bioengineering / ed. by W. G. Flynne. — 2008. — P. 37—73. — ISBN 978-1-60456-067-1. Архивировано 3 августа 2023 года.
- ↑ Prydz K., Dalen K. T. Synthesis and sorting of proteoglycans (англ.) // Journal of Cell Science. — 2000. — Vol. 113, iss. 2. — P. 193—205. — ISSN 0021-9533. — doi:10.1242/jcs.113.2.193. — PMID 10633071.
- ↑ Esko J. D., Kimata K., Lindahl U. Chapter 16: Proteoglycans and Sulfated Glycosaminoglycans (англ.) // Essentials of Glycobiology. — Cold Spring Harbor Laboratory Press, 2009. — ISBN 978-0879695590. Архивировано 19 декабря 2022 года.