Апремиласт
| Апремиласт | |
|---|---|
 | |
 | |
| Химическое соединение | |
| ИЮПАК | N-{2-[(1S)-1-(3-Ethoxy-4-methoxyphenyl)-2-(methylsulfonyl)ethyl]-1,3-dioxo-2,3-dihydro-1H-isoindol-4-yl}acetamide |
| Брутто-формула | C22H24N2O7S |
| Молярная масса | 460.500 г/моль |
| CAS | 608141-41-9 |
| PubChem | 11561674 |
| DrugBank | DB05676 |
| Состав | |
| Классификация | |
| АТХ | L04AA32 |
| Фармакокинетика | |
| Биодоступн. | 73%;[1] Tmax = ~2.5 hours |
| Связывание с белками плазмы | ~68%[1] |
| Метаболизм | Liver (CYP3A4, with minor contributions from CYP2A6, CYP1A2) |
| Период полувывед. | 6–9 hours[1] |
| Экскреция | Urine (58%), faeces (39%)[1] |
| Способы введения | |
| Oral (tablets) | |
| Другие названия | |
| Otezla | |
Апремиласт — пероральное лекарственное средство, относится к группе избирательных иммунодепрессантов, которые модулируют работу медиаторов воспаления.
Механизм действия
Апремиласт представляет собой малую молекулу. Это ингибитор фосфодиэстеразы 4 (ФДЭ4), который действует внутри клетки, модулируя провоспалительные и противовоспалительные медиаторы. Угнетение ФДЭ4 ведет к снижению воспалительной реакции за счет модуляции экспрессии воспалительных цитокинов - TNF-α, IL-23, IL-17 и других. Эти про- и противовоспалительные медиаторы участвуют в патогенезе псориаза и псориатического артрита.
Фармакокинетические свойства
- Всасывание - апремиласт хорошо всасывается, его абсолютная биодоступность после приема внутрь составляет примерно 73%. Медиана времени достижения (tmax) максимальной концентрации в плазме крови (Cmax) приблизительно 2,5 часа. Фармакокинетика апремиласта линейная, с пропорциональным дозе (в пределах 10-100 мг в сут) увеличением степени воздействия. После приема один раз в день накопление соединения минимально, а после применения дважды в день составляет примерно 53% у здоровых людей и 68% у больных псориазом. Биодоступность апремиласта не нарушается при его применении с едой, поэтому препарат можно использовать вне зависимости от приема пищи.
- Распределение - у человека апремиласт связывается с белками плазмы крови примерно на 68%. Средний объем распределения (Vd) составляет 87 л, что свидетельствует о внесосудистом распространении.
- Элиминация - у здоровых людей конечный период полувыведения апремиласта в среднем 9 часов, с мочой выводится около 58% и 39% - с калом.
Показания к применению
В 2014 году апремиласт одобрен для применения в США[2][3] и Европейском Союзе[4] в монотерапии или в комбинации с противоревматическими средствами для лечения взрослых людей со следующими состояниями:
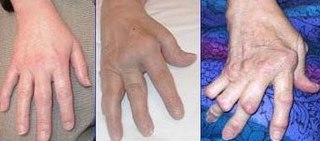
- Псориатический артрит – при неэффективности или непереносимости предшествующей терапии «противоревматическими средствами, модифицирующими течение заболевания» (ПРСМТЗ).
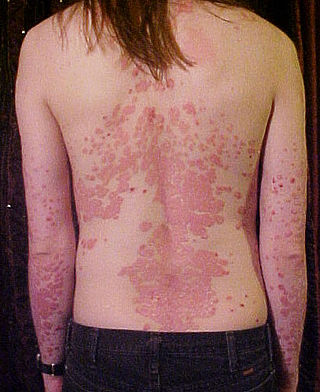
- Псориаз - воспалительное заболевание кожи, которое может вызывать покраснение, чешуйчатость, утолщение, зуд и боль участков кожи, а также поражать волосистую часть кожи головы и ногти.
- Умеренный или тяжелый бляшковый псориаз – при отсутствии ответа на лечение или наличии противопоказаний или непереносимости к другой системной терапии, включая циклоспорин, метотрексат или псорален и ультрафиолетовое-А облучение (ПУВА).
- Язвы полости рта при болезни Бехчета. Одобрен в 2019 г.[5][3]
С 2018 года входит в Перечень ЖНВЛП.
Дозирование и способ применения
Лечение препаратом апремиласт должно проводиться врачом-специалистом, имеющим достаточный опыт в диагностике и лечении псориаза и псориатического артрита. Рекомендуемая доза - 30 мг внутрь два раза в день, утром и вечером, с интервалом 12 часов вне зависимости от приема пищи. Рекомендуется начальное титрование дозы.[6] Коррекция дозы у пожилых пациентов, больных с почечной (с умеренной и средней степенью) или печеночной недостаточностью не требуется. У больных с тяжелой почечной недостаточностью (клиренс креатинина менее 30 мл/мин при определении по формуле Кокрофта-Голта) дозировку апремиласта следует уменьшить до 30 мг один раз в сутки. Эффективность и безопасность апремиласта у детей в возрасте 0-17 лет не изучалась.
Противопоказания
Гиперчувствительность к активной субстанции или любым вспомогательным веществам. Беременность.
Взаимодействия с другими медицинскими продуктами и другие виды взаимодействия
Совместное применение с активным индуктором цитохрома P450 3A4 (CYP3A4) рифампицином ведет к ослаблению системного воздействия апремиласта и уменьшению его эффективности. Поэтому не рекомендуется комбинированное использование активных индукторов CYP3A4 (например., рифампицина, фенобарбитала, карбамазепина, фенитоина, продуктов зверобоя) с апремиластом.
Результаты клинических исследований
Псориатический артрит
Безопасность и эффективность апремиласта были изучены в 3-х многоцентровых, рандомизированных, двойных слепых, плацебо контролируемых исследованиях (исследования PALACE 1, PALACE 2 и PALACE 3) со сходным дизайном у взрослых больных активным псориатическим артритом (ПсА) (≥ 3 опухание суставов и ≥ 3 болезненность суставов) вне зависимости от предыдущего лечения препаратами. Всего рандомизировано 1493 больных, которые получали плацебо ± ПРСМТЗ, апремиласт 20 мг или 30 мг два раза в день внутрь ± ПРСМТЗ. В соответствии с дизайном больные, у которых показатели болезненности и опухлости суставов не снизились более чем на 20% к 16-й неделе, считались неотвечающими на лечение. Пациенты группы плацебо ± ПРСМТЗ, которые также не дали ответа, были повторно рандомизированы в соотношении 1:1 слепым методом и получали апремиласт 20 мг или 30 мг дважды в день. После 24-й недели все оставшиеся больные группы плацебо были переведены на апремиласт 20 мг или 30 мг дважды в день. Целевым критерием был процент больных с улучшением на 20% (ACR20) на неделе 16 по классификации Американского колледжа ревматологии (American College of Rheumatology: ACR). У больных, которые получали апремиласт 30 мг дважды в день, как минимум “ACR20 ответ” был достигнут у 53,9% пациентов, различия с группой плацебо ± ПРСМТЗ (26,7%) статистически достоверно. Ответы ACR 20/50/70 сохранялись на 24-й неделе. Из 497 больных, первоначально распределенных в группу с апремиластом по 30 мг 2 раза в день, 375 (75%) продолжали лечение препаратом на 52-й неделе. В этот период ответы ACR 20/50/70 зарегистрированы соответственно у 57%, 25% и 11% пациентов. Физическое состояние определяли по индексу нетрудоспособности вопросника оценки здоровья (HAQ-DI). Апремиласт по сравнению с плацебо ± ПРСМТЗ значительно улучшал состояние здоровья по сравнению с исходным на неделе 16 в исследованиях PALACE 1, PALACE 2 и PALACE 3. Это улучшение сохранялось и на 24-й неделе.
Псориаз
Эффективность и безопасность апремиласта при псориазе изучена в двух многоцентровых, рандомизированных, двойных слепых, плацебо контролируемых исследованиях (исследования ESTEEM 1 и ESTEEM 2) у 1257 больных умеренным или тяжелым бляшковым псориазом со схожим дизайном. Площадь пораженной псориазом поверхности тела (a body surface area; BSA) была ≥ 10%, значение индекса распространеннсти и тяжести псориаза (Psoriasis Area and Severity Index; PASI) ≥ 12, значение статической общей оценки врачом (Physician Global Assessment; PGA) ≥ 3 (умеренная или тяжелая). Все больные были кандидатами на фототерапию или системную терапию. Больных рандомизировали в соотношении 2:1 в группы с апремиластом 30 мг дважды в день и плацебо в течение 16 недель (плацебо контролируемая фаза). В период с 16 по 32-ю неделю все пациенты получали апремиласт 60 мг/сутки (фаза лечения). Во время рандомизированной фазы отмены лечения (неделя 32-52), больные, которых начинали лечить апремиластом и у которых достигнуто снижение значения PASI не менее, чем на 75% (PASI-75) (ESTEEM 1) или 50% (PASI-50) (ESTEEM 2) на неделе 32 повторно рандомизировали в группу с плацебо или с апремиластом в дозе 60 мг/сутки. В ходе исследований допускалось местное нанесение кортикостероидов на область лица, подмышек и паха или дегтярных шампуней, растворов салициловой кислоты для нанесения на кожу головы. Кроме того, на неделе 32 у больных, у которых не достигнуто значение PASI-75 в исследовании ESTEEM 1 или PASI-50 в исследовании ESTEEM 2, для лечения местных поражений разрешалось использовать препараты для местного лечения псориаза и/или фототерапию в дополнение к апремиласту в дозе 60 мг/сутки. В обоих исследованиях основным целевым критерием было количество больных, у которых достигнуто значение PASI-75 на неделе 16. Апремиласт значимо улучшал состояние больных умеренным и тяжелым псориазом, о чем свидетельствовало достоверно большее количество больных со значениями PASI-75 на неделе 16 по сравнению с плацебо (28,8 vs. 5,8% в исследовании ESTEEM 1 и 33,1% vs. 5,31% в исследовании ESTEEM II). Кроме того, была показана эффективность апремиласта в отношении комплекса проявлений псориаза, включая зуд, поражения ногтей и волосистой части головы, а также качества жизни.
Нежелательные эффекты
В клинических исследованиях фазы III наиболее частыми нежелательными явлениями (НЯ) были нарушения со стороны ЖКТ - диарея (15,7%) и тошнота (13,9%). В основном эти нарушения были легкой или средней степени тяжести и только в 0,3% случаев диареи и тошноты нежелательные являения были расценены как тяжелые. Эти побочные реакции возникали преимущественно в первые две недели лечения и обычно исчезали через четыре недели. Другими частыми нежелательными явлениями были инфекции верхних дыхательных путей (8,4%), головная боль (7,9%) и головная боль напряжения (7,2%). В целом, большинство побочных реакций классифицированы как легкие или умеренные. Общая частота серьезных нежелательных реакций была низкой. и они не были специфичными для какой-либо системы органов. Наиболее частыми побочными реакциями, ставшими причиной прекращения лечения в первые 16 недель, были диарея (1,7%) и тошнота (1,5%).
Ссылки
- Апремиласт (Apremilast) - Энциклопедия лекарств и товаров аптечного ассортимента. РЛС Патент. — Действующее вещество.
- Development of analogs of thalidomide
Подробная информация по медицинскому продукту представлена на веб-сайте Европейского медицинского агентства[7]
Примечания
- ↑ 1 2 3 4 Otezla (aprelimast) dosing, indications, interactions, adverse effects, and more. Medscape Reference. WebMD. Дата обращения: 28 марта 2014. Архивировано 17 октября 2014 года.
- ↑ CDER New Molecular Entity (NME) and Biologic Approvals Calendar Year 2014 (англ.). FDA. Дата обращения: 12 апреля 2020. Архивировано 6 апреля 2017 года.
- ↑ 1 2 OTEZLA- apremilast kit OTEZLA- apremilast tablet, film coated (англ.). DailyMed. U. S. National Library of Medicine.
- ↑ Одобрение в Евросоюзе (англ.). Дата обращения: 8 апреля 2015. Архивировано 2 апреля 2015 года.
- ↑ New Drug Therapy Approvals 2019 (англ.). FDA. Дата обращения: 3 ноября 2020. Архивировано 16 сентября 2020 года.
- ↑ Официальный сайт производителя. Дата обращения: 16 июля 2015. Архивировано 20 июля 2015 года.
- ↑ EMA (англ.). Дата обращения: 15 июля 2015. Архивировано 15 декабря 2020 года.