Аргинин
| Аргинин | |
|---|---|
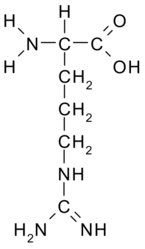    | |
| Общие | |
| Систематическое наименование | 2-амино-5-(диаминометилиденамино)пентановая кислота |
| Сокращения | Арг, Arg, R CGU,CGC,CGA,CGG;AGA,AGG |
| Хим. формула | (NH-C(NH2)NH(CH2)3CH(NH2)-COOH) |
| Рац. формула | C6H14N4O2 |
| Физические свойства | |
| Молярная масса | 174,2 г/моль |
| Химические свойства | |
| Константа диссоциации кислоты | 12,48 |
| Классификация | |
| Рег. номер CAS | 74-79-3 |
| PubChem | 6322 и 28782 |
| Рег. номер EINECS | 200-811-1 |
| SMILES | |
| InChI | |
| ChEBI | 16467 |
| ChemSpider | 6082 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Аргини́н (2-амино-5-гуанидинпентановая кислота) — алифатическая основная α-аминокислота. Является одной из двух условно-незаменимых аминокислот (наряду с гистидином). Оптически активна, существует в виде L- и D- изомеров. L-Аргинин входит в состав пептидов и белков, особенно высоко содержание аргинина в основных белках — гистонах и протаминах (до 85 %). Новое исследование позволяет предположить, что чрезмерное потребление аргинина иммунными клетками, которые обычно защищают мозг, является причиной возникновения болезни Альцгеймера[1], т.к. возникает дефицит аргинина.
Химические свойства
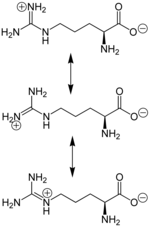
Аргинин является основной аминокислотой, несущей два основных центра: аминогруппу в α-положении и гуанидиновую в δ-положении. Гуанидиновая группа благодаря резонансной делокализации заряда при протонировании является сильно основной (pKa 12.48), находится в протонированной катионной форме при pH < 10 и способна образовывать множественные водородные связи. В слабощелочных и нейтральных растворах аргинин образует цвиттер-ион. Высокая основность аргинина и, соответственно, способность образовывать ионные связи с фосфатными группами ДНК, обуславливает образование нуклеопротеидов — комплексов гистон-ДНК хроматина и протамин-ДНК гетерохроматина сперматозоидов.
Биологические свойства
Аргинин — в большинстве случаев незаменимая аминокислота. У взрослого и здорового человека аргинин может вырабатываться организмом. В то же время для детей и подростков, пожилых и больных людей эта аминокислота является действительно незаменимой, так как уровень её синтеза часто недостаточен. Биосинтез аргинина осуществляется из цитруллина под действием аргининсукцинатсинтазы и аргининсукцинатлиазы.
Аргинин является одним из ключевых метаболитов в процессах азотистого обмена (в частности, в орнитиновом цикле млекопитающих и рыб).
Аргинин является субстратом NO-синтаз в синтезе оксида азота NO, являющегося локальным тканевым гормоном с множественными эффектами — от противовоспалительного до сосудистых эффектов (вазодилатация) и стимуляции ангиогенеза.[2]
Содержание в продуктах питания
L-Аргинин встречается во многих продуктах питания, как животного, так и растительного происхождения. В таблице приведены данные по содержанию аргинина на 100 грамм продукта и указано содержание белка.
| Продукт | Белок | Аргинин | А/Б |
|---|---|---|---|
| Свинина сырая | 20,95 г | 1394 мг | 6,7 % |
| Сырое куриное филе | 21,23 г | 1436 мг | 6,8 % |
| Сырое филе лосося | 20,42 г | 1221 мг | 6,0 % |
| Куриное яйцо | 12,57 г | 820 мг | 6,5 % |
| Коровье молоко, 3,7 % жирности | 3,28 г | 119 мг | 3,6 % |
| Кедровые орехи | 13,69 г | 2413 мг | 17,6 % |
| Грецкие орехи | 15,23 г | 2278 мг | 15,0 % |
| Тыквенные семечки | 30,23 г | 5353 мг | 17,7 % |
| Пшеничная мука г/п | 13,70 г | 642 мг | 4,7 % |
| Кукурузная мука | 6,93 г | 345 мг | 5,0 % |
| Рис нешлифованный | 7,94 г | 602 мг | 7,6 % |
| Гречишный хлеб | 13,25 г | 982 мг | 7,4 % |
| Горох сушёный | 24,55 г | 2188 мг | 8,9 % |
Применение
Лекарственные средства
Аргинин присутствует в рецептуре гепатопротекторов[3], иммуномодуляторов[4], кардиологических препаратов, лекарственных препаратов для ожоговых больных, больных ВИЧ/СПИД, а также в рецептурах средств для парентерального питания в послеоперационный период.
Проводится тестирование L-аргинина в качестве средства терапии инсультоподобных эпизодов при митохондриальном заболевании — синдроме MELAS.[5][6][7][8]
Пищевые добавки
Аргинин широко рекламируется как компонент БАД для бодибилдеров и спортсменов-тяжелоатлетов с целью улучшения питания мышц (например, в составе аргинин альфа-кетоглютарата). Также массово применяется аргинин и в пищевых добавках, рекламируемых «в целях стимулирования иммунитета». А также аргинин стимулирует выброс гормона роста, который, в свою очередь, влияет на омоложение всего организма, уменьшает количество подкожного жира, увеличивает анаболизм. Аргинин является донором оксида азота,[2] открытие биологических эффектов которого было удостоено Нобелевской премии в медицине.[9]
См. также
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Примечания
- ↑ A New Potential Cause for Alzheimer’s: Arginine Deprivation. Дата обращения: 15 апреля 2015. Архивировано 17 апреля 2015 года.
- ↑ 1 2 Andrew, P.J.; Myer, B. Enzymatic function of nitric oxide synthases (англ.) // Cardiovascular Research[англ.] : journal. — 1999. — August 15 (vol. 43, no. 3). — P. 521—531 REVIEW. — doi:10.1016/S0008-6363(99)00115-7. — PMID 10690324. [1] Архивная копия от 4 июня 2009 на Wayback Machine
- ↑ ГЛУТАРГИН (аргинина глутамат)."По мотивам гепатопротекторной прозы". Дата обращения: 8 июня 2014. Архивировано 10 июля 2014 года.
- ↑ ARGININ.RU — L-Arginin. Дата обращения: 8 июня 2014. Архивировано из оригинала 27 мая 2014 года.
- ↑ Koga Y., Akita Y., Junko N., Yatsuga S., Povalko N., Fukiyama R., Ishii M., Matsuishi T. Endothelial dysfunction in MELAS improved by l-arginine supplementation (англ.) // Neurology : journal. — 2006. — June (vol. 66, no. 11). — P. 1766—1769. — doi:10.1212/01.wnl.0000220197.36849.1e. — PMID 16769961. Архивировано 16 октября 2019 года.
- ↑ Koga Y. [L-arginine therapy on MELAS] (яп.) // Rinsho Shinkeigaku. — 2008. — Ноябрь (т. 48, № 11). — С. 1010—1012. — PMID 19198147.
- ↑ Koga Y., Akita Y., Nishioka J., Yatsuga S., Povalko N., Katayama K., Matsuishi T. MELAS and L-arginine therapy (неопр.) // Mitochondrion. — 2007. — Т. 7, № 1—2. — С. 133—139. — doi:10.1016/j.mito.2006.11.006. — PMID 17276739. Архивировано 1 апреля 2019 года.
- ↑ Finsterer J. Management of mitochondrial stroke-like-episodes (неопр.) // Eur. J. Neurol.[англ.]. — 2009. — November (т. 16, № 11). — С. 1178—1184. — doi:10.1111/j.1468-1331.2009.02789.x. — PMID 19780807. (недоступная ссылка)
- ↑ The Nobel Prize in Physiology or Medicine 1998 — Robert F. Furchgott, Louis J. Ignarro, Ferid Murad. Дата обращения: 18 марта 2013. Архивировано 12 марта 2013 года.