Аскаридол
| Аскаридол | |
|---|---|
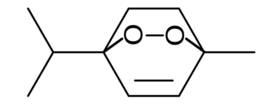 | |
| Систематическое название | 1-метил-4-(1-метилэтил)-2,3-диоксабицикло[2.2.2]окт-5-ен |
| Химическая формула | C10H16O2 |
| Внешний вид | жидкость |
| Свойства | |
| Молярная масса | 168,23 г/моль |
| Температура плавления | 3,3[1] °C |
| Температура кипения | 40 °C (313,15 К) |
| Плотность | 1,010 г/см³ |
| Классификация | |
| Регистрационный номер CAS | 512-85-6 |
| PubChem | 10545 |
| Код SMILES | O1OC2(\C=C/C1(C)CC2)C(C)C |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
Аскаридол — естественное органическое соединение, классифицирующееся как бициклический монотерпен, имеющий мостиковую пероксогруппу. Соединение является бесцветной жидкостью с резким запахом и вкусом, растворимым в большинстве органических растворителей. Является неустойчивым соединением, как и большинство низкомолекулярных органических пероксидов, способным к взрыву при нагревании или реакции с органическими кислотами. Аскаридол определяет специфический аромат чилийского пеумуса и является основным компонентом масла Dysphania ambrosioides. Аскаридол является компонентом естественной медицины, тоником для напитков и еды в латиноамериканской кухне. Являясь частью масла, аскаридол применяется в глистогонных препаратах, которые выводят паразитических червей из растений, домашних животных и человека.
История


Аскаридол на протяжении долгих лет считался органическим пероксидом натурального происхождения. В 1908 году Хютиг выделил из растения мари соединение, дал ему название, описал взрывной характер соединения и определил его химическую формулу как C10H16O2. Хютиг отметил отличие аскаридола от альдегидов, кетонов или фенолов, что позволило ему охарактеризовать соединение как не являющееся спиртом. При реакции с серной кислотой, или при реакции с порошкообразным цинком и уксусной кислотой, продуктами реакции являлся цимол[2][3]. Эти данные были подтверждены в детальном изучении И. К. Нильсона в 1911 году; в частности, было подтверждено, что аскаридол взрывается при нагреве, при реакции с серной, соляной, азотной, фосфорной кислотами. Нельсон показал, что соединение содержит или гидроксильную, или карбонильную группу, и что при окислении сульфата железа оно образует аскаридола гликоль (C10H18O3). Последнее соединение более стабильно, чем аскаридол, и имеет более высокую температуру плавления (64 °C), кипения (272 °C) и плотность 1,098 г/см³. Нельсон почти правильно определил структуру молекулы аскаридола, однако ошибка состояла в том, что по его мнению пероксогруппа проходила не через кольцо, а соединялось с другими атомами углерода, не входящими в кольцо[4]. Правильно структуру определил Отто Валлах в 1912 году[5][6][7].
Первый лабораторный синтез был проведен Гюнтером Шенком и Карлом Циглером. Синтез производился благодаря реакции α-Терпинена с кислородом в хлорофилле и на свету. В этой реакции образуется синглетный кислород, который по механизму реакции Дильса-Альдера реагирует с диеновой системой в терпинене[7][8][9]. С 1945 года эта реакция стала применяться в промышленном синтезе аскаридола в Германии. Затем это соединение стало применяться в качестве недорогого лекарства против кишечных червей[10].
Свойства
Аскаридол представляет собой бесцветную жидкость. Соединение токсично. Выше 130 °C взрывается. При нагревании испускает токсичные и, возможно, канцерогенные пары[1][5][11].
Нахождение в природе

Специфический аромат чилийского дерева болдо (Peumus boldus) происходит от аскаридола. Аскаридол также является главным компонентом мари душистой (Dysphania ambrosioides)[12][13][14], где его обычная концентрация составляет 16—70 % в эфирном масле[15][16]. Содержание аскаридола в растениях зависит от условий выращивания и максимально, когда соотношение азота к фосфору равно 1:4. Концентрация соединения меняется, когда семена растения достигают зрелости[17].
Применение
Аскаридол применяется главным образом как глистогонное средство. Благодаря этому свойству название соединению было дано в честь рода паразитических червей Ascaris[англ.]. В начале 1900-х гг. соединение являлось основным средством против кишечных паразитов в организме человека, кошек, собак, овец, кур, лошадей и свиней, и он все еще находит своё применение в животноводстве, особенно в странах Латинской Америки. Дозировка определялась содержанию аскаридола в масле, которое высчитывалось опытом Нельсона, проведенном в 1920 году. Позднее метод был заменён современными газовой хроматографией и масс-спектрометрией[18]. Черви и их личинки умирают при их помещении в водный раствор аскаридола (около 0,0015 % по объёму) на 18 (10 °C), 12 (16 °C) или 6 часов (18—21 °C). Между тем, на протяжении 15 или более часов при температуре 21 °C корни и стебли растений ириса, флокса, седума в таком растворе не подвергаются повреждениям[11].
Масло эпазота традиционно применяется для ароматизации блюд и предотвращения метеоризма от бобовосодержащей пищи[16]. Масло является частью тонизирующих напитков и настоек против кишечных паразитов и лечения астмы, артрита, дизентерии, малярии и нервных заболеваниях. В народной медицине применяется в Северной и Южной Америке, Китае, Турции[17][18].
Опасность применения
Применение аскаридола в человеческом организме ограничено в силу токсичности аскаридола и потому не рекомендуется. В больших дозах масло эпазота вызывает раздражение кожи, слизистой оболочки, тошноту, рвоту, запор, головную боль, головокружение, шум в ушах, временную глухоту и слепоту. Длительное воздействие вызывает депрессию центральной нервной системы и бред, который переходит в судороги и кому. Долгосрочные эффекты вызывают отек легких (накопление жидкости в легких), гематурию и альбуминурию (наличие красных кровяных клеток и белков в моче соответственно) и желтуху. Фатальная доза масла была зарегистрирована как одна чайная ложка для 14-и месячного ребенка (сразу) и ежедневный прием 1 мл в течение трех недель для детей до двух лет. Аскаридол вызывал канцерогенный эффект у крыс[16].
Примечания
- ↑ 1 2 Richard J. Lewis, Richard J. Lewis (Sr.). Hazardous chemicals desk reference. — 6-е изд. — Wiley-Interscience, 2008. — 1953 с. — ISBN 0470180242, 9780470180242.
- ↑ Schimmel's Report. — апрель 1908. — С. 108.
- ↑ Арбузов, Ю. А. The Diels-Alder Reaction With Molecular Oxygene as Dienophile (англ.) // Журнал Russian Chemical Reviews : статья. — 1965. — Iss. 34, no. 8. — doi:10.1070/RC1965v034n08ABEH001512.
- ↑ Nelson, E. K. A Chemical Investigation of the Oil of Chenopodium (англ.) // Журнал J. Am. Chem. Soc : статья. — август 1911. — Iss. 33, no. 8. — P. 1404—1412. — doi:10.1021/ja02221a016.
- ↑ 1 2 O. Wallach. Zur Kenntnis der Terpene und der ätherischen Öle (англ.) // Журнал Justus Liebig's Annalen der Chemie : статья. — 1912. — Iss. 392, no. 1. — P. 49—75. — doi:10.1002/jlac.19123920104.
- ↑ Nelson, E. K. A Chemical Investigation of the Oil of Chenopodium. II (англ.) // Журнал J. Am. Chem. Soc : статья. — январь 1913. — P. 84—90. — doi:10.1021/ja02190a009.
- ↑ 1 2 E. K. Nelson. The Terpenes. — CUP Archive. — С. 446—452.
- ↑ Pape, M. Industrial applications of photochemistry (англ.) // Журнал Pure and Applied Chemistry : статья. — 1975. — Iss. 41, no. 4. — P. 535. Архивировано 29 июня 2011 года.
- ↑ Günther, O. Schenck and K. Ziegler. Die Synthese des Ascaridols (англ.) // Журнал Naturwissenschaften : статья. — 1944. — Iss. 32номер=14—26. — doi:10.1007/BF01467891.
- ↑ William H. Brown, Christopher S. Foote, Brent L. Iverson, Eric V. Anslyn. Organic chemistry. — Cengage Learning, 2009. — С. 967. — 1132 с. — ISBN 0495388572.
- ↑ 1 2 United States. Dept. of Agriculture. Technical bulletin, Выпуск 1441. — 1972. — С. 65.
- ↑ Энциклопедический словарь лекарственных, эфирномасличных и ядовитых растений / Сост. Г. С. Оголевец. — М.: Сельхозгиз, 1951. — С. 25. — 584 с.
- ↑ Jorge E. Garro Alfaro. Plantas Competidoras. Un Componente MÁs de Los Agroecosistemas. — EUNED. — С. 245. — 260 с. — ISBN 9968312355, 9789968312356.
- ↑ Ana Luisa Anaya Lang. Ecología Química. — Plaza y Valdes, 2003. — С. 323. — 349 с. — ISBN 9707221135, 9789707221130.
- ↑ Humphrey Paget. Chenopodium oil. Part III. Ascaridole (англ.) // Журнал J. Chem. Soc : статья. — 1938. — Iss. 392, no. 1. — P. 829—833. — doi:10.1039/JR9380000829.
- ↑ 1 2 3 Ellene Tratras Contis. Food flavors: formation, analysis, and packaging influences : proceedings of the 9th International Flavor Conference, the George Charalambous Memorial Symposium, Limnos, Greece, 1-4 July 1997. — Elsevier, 1998. — С. 408—409. — 797 с. — ISBN 0444825908, 9780444825902.
- ↑ 1 2 Ernest Small, National Research Council Canada. Culinary herbs. — 2-е изд. — NRC Research Press, 2006. — С. 295—296. — 1036 с. — ISBN 0660190737, 9780660190730.
- ↑ 1 2 Chenopodium ambrosioides (англ.). Cornell Univesity. Department of Animal Science. Дата обращения: 4 января 2011. Архивировано 9 июля 2012 года.