
Транспортная РНК, тРНК — рибонуклеиновая кислота, обеспечивающая взаимодействие аминокислоты, рибосомы и матричной РНК (мРНК) в ходе трансляции. Имеет типичную длину от 73 до 93 нуклеотидов и размеры около 5 нм. тРНК, будучи ковалентно связаны с остатком аминокислоты, принимает непосредственное участие в наращивании полипептидной цепи, специфически присоединяясь к кодону мРНК и обеспечивая необходимую для образования новой пептидной связи конформацию комплекса.

В биологии активный центр — это область фермента, где молекулы субстрата связываются и подвергаются химической реакции. Активный центр состоит из аминокислотных остатков, которые образуют временные связи с субстратом, и остатков, которые катализируют реакцию этого субстрата. Хотя активный центр занимает только ~ 10-20 % от объёма фермента он является наиболее важной частью, поскольку он непосредственно катализирует химическую реакцию. Обычно активный центр состоит из трех-четырех аминокислот, в то время как другие аминокислоты в белке необходимы для поддержания его третичной структуры.
Тромбин (фактор свёртывания IIа) — сериновая протеаза, важнейший компонент системы свёртывания крови человека и животных. Тромбин относится к ферментам класса гидролаз, ген F2, кодирующий данный фермент, локализован на коротком плече (p-плечо) 11-ой хромосомы человека. Катализирует гидролиз пептидных связей, образованных остатками аргинина и лизина, обладает ограниченной субстратной специфичностью. Главная его функция — превращение фибриногена в фибрин. Он действует также на несколько других факторов свертывания.

Убиквити́н — небольшой консервативный белок эукариот, участвующий в регуляции процессов внутриклеточной деградации других белков, а также в модификации их функций. Он присутствует почти во всех тканях многоклеточных эукариот, а также у одноклеточных эукариотических организмов. Убиквитин был открыт в 1975 году Гидеоном Голдштейном с соавторами и охарактеризован в 70—80-х годах XX века. В геноме человека есть четыре гена, кодирующих убиквитин: UBB, UBC, UBA52 и RPS27A.

Убиквитинлигаза — фермент-лигаза, ковалентно присоединяющий убиквитин к белку-мишени изопептидной связью. Убиквитинлигазы являются частью системы убиквитинопосредованного распада белка в протеасомах. Известно, что протеасома расщепляет не любые белки, а только те, которые были «помечены» убиквитином. Убиквитинлигазы специфично узнают белки-субстраты и участвуют в их полиубиквитинировании, которое, в конечном счёте, приводит к деградации последних в протеасомах. Кроме этого, убиквитинлигазы осуществляют и другие модификации белков убиквитином, такие как моноубиквитинирование и мультиубиквитинирование, которые имеют регуляторное значение. В геноме человека обнаружено более 500 генов убиквитинлигаз.

Аллопуринол — лекарственный препарат, используемый в основном при гиперурикемии и её осложнениях, таких как подагра.

Ангиотензинпревращающий фермент, также CD143 — протеолитический фермент (экзопептидаза), циркулирующий во внеклеточном пространстве и катализирующий расщепление декапептида ангиотензина I до октапептида ангиотензина II. Обе формы ангиотензина играют важнейшую роль в ренин-ангиотензиновой системе, регулирующей кровяное давление в организме. Вторая важная функция АПФ — это инактивация брадикинина.

Аквапорин 8 — белок группы аквапоринов, водный канал. Чувствителен к ртути, не проницаем для глицерина и мочевины.

Дезоксирибонуклеаза I — эндонуклеаза, закодированная геном DNASE1 в геноме человека. Синтезируется в основном в тканях пищеварительного тракта. Высокий уровень в моче, также присутствует в семенной жидкости и слюне.

CD81 — мембранный белок из надсемейства тетраспанинов, продукт гена человека TSPAN28.

Ферредоксин-зависимая нитритредуктаза – это фермент, который катализирует реакцию:

Инсулиновый рецептор (IR) — трансмембранный рецептор, который активируется инсулином, IGF-I, IGF-II и принадлежит к большому классу тирозинкиназных рецепторов. Инсулиновый рецептор играет ключевую роль в регуляции гомеостаза глюкозы, функционального процесса, который при дегенеративных условиях может привести к ряду клинических проявлений, в том числе диабету и раку. Биохимически инсулиновый рецептор кодируется одним геном INSR, альтернативный сплайсинг которого в ходе транскрипции производит либо к IR-A-либо к IR-B-изоформам. Последующие посттрансляционные события каждой изоформы приводят к формированию протеолитически расщеплённых α и β-субъединиц, которые при объединении, в конечном счете способны к димеризации с получением дисульфидно связанного трансмембранного инсулинового рецептора массой ≈ 320 кДа.
Ацил-КоА-дегидрогеназы, также ACADs — семейство ферментов из класса оксидоредуктаз, которые катализируют реакции переноса протона (дегидрогенизация) от субстрата — ацил-КоА жирной кислоты на электрон-переносящий флавопротеин (FAD), участвуют в процессе β-окисления. Результатом реакции является образование двойной связи расположенной между атомами С2 (α) и С3 (β) в молекуле тиоэфира субстрата (ацил-КоА).
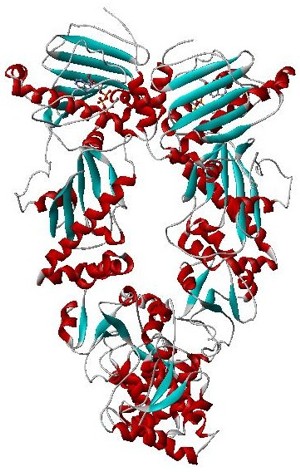
Hsp90, также белок теплового шока 90 — это белок-шаперон, который помогает другим белкам правильно складываться, стабилизирует белки от теплового стресса и способствует деградации белка. Он также стабилизирует ряд белков, необходимых для роста опухоли, поэтому ингибиторы Hsp90 исследуются как противораковые лекарственные средства.

Рецепторные тирозинкиназы, рецепторы с тирозинкиназной активностью — метаботропные клеточные рецепторы, представляют собой трансмембранные белки, которые состоят из каталитического внутриклеточного домена, участвующего в фосфорилировании субстратов (тирозинкиназа), трансмембранного и внешнего домена (связывающего) с высоким сродством к лигандам: гормонам (инсулин), цитокинам и полипептидным факторам роста. Из 90 уникальных генов тирозинкиназы, идентифицированных в геноме человека, 58 кодируют рецепторные тирозинкиназы.

B-Raf, или c-RAF — цитозольная серин/треониновая протеинкиназа семейства MAP3K. Продукт протоонкогена B-Raf BRAF.
Сортаза A представляет собой фермент. Этот фермент катализирует следующую химическую реакцию
- Фермент катализирует реакцию сортировки клеточной стенки, в которой поверхностный белок с сигналом сортировки, содержащий мотив LPXTG, расщепляется между остатками Thr и Gly.
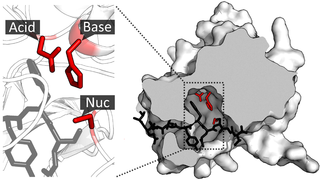
Каталитическая триада — это набор из трех скоординированных аминокислот, которые можно найти в активном центре некоторых ферментов. Каталитические триады чаще всего встречаются в ферментах гидролаз и трансфераз. Триада кислота-основание-нуклеофил является распространенным мотивом для образования нуклеофильного остатка для ковалентного катализа. Остатки образуют сеть реле заряда для поляризации и активации нуклеофила, который атакует субстрат, образуя ковалентный промежуточный продукт, который затем гидролизуется с высвобождением продукта и регенерацией свободного фермента. Нуклеофилом чаще всего является аминокислота серин или цистеин, но иногда треонин или даже селеноцистеин. Трехмерная структура фермента объединяет триадные остатки в точной ориентации, даже если они могут находиться далеко друг от друга в последовательности.

В биохимии аллостерическая регуляция — это регуляция фермента путем связывания эффекторной молекулы в сайте, отличном от активного сайта фермента.
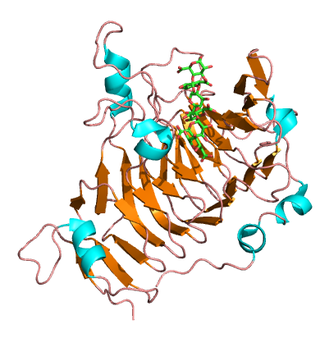
Пектинэстераза (PE) — это широко распространённый фермент, связанный с клеточной стенкой, который представляет несколько изоформ, которые способствуют модификации и последующему разрушению клеточной стенки растений. Он содержится во всех высших растениях, а также в некоторых бактериях и грибах. Пектинэстераза действует, прежде всего, за счёт изменения локального pH клеточной стенки, что приводит к нарушениям целостности клеточной стенки.

















