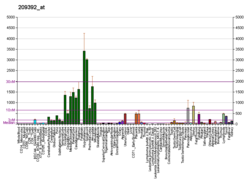
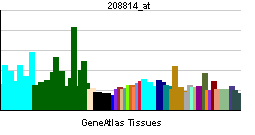
Аутотаксин
| Аутотаксин | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | ENPP2, ATX, ATX-X, AUTOTAXIN, LysoPLD, NPP2, PD-IALPHA, PDNP2, ectonucleotide pyrophosphatase/phosphodiesterase 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние ID | OMIM: 601060 MGI: 1321390 HomoloGene: 4526 GeneCards: ENPP2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Аутотаксин, также известный как член семейства 2 эктонуклеотидпирофосфатазы/фосфодиэстеразы (E-NPP 2), является ферментом, который у людей кодируется геном ENPP2[5][6].
Функция
Аутотаксин, также известный как эктонуклеотидпирофосфатаза/фосфодиэстераза 2 (NPP2 или ENPP2), является секретируемым ферментом, важным для генерации липидной сигнальной[англ.] молекулы лизофосфатидной кислоты (ЛФК). Аутотаксин обладает активностью лизофосфолипазы D, которая превращает лизофосфатидилхолин в ЛФК.
Первоначально аутотаксин был идентифицирован как фактор, стимулирующий подвижность опухолевых клеток; позже было показано, что это ЛФК (которая сигнализирует через лизофосфолипидные рецепторы), липидный продукт реакции, катализируемой аутотаксином, который отвечает за его влияние на пролиферацию клеток.
Белок, кодируемый этим геном, функционирует как фосфодиэстераза. Аутотаксин секретируется и подвергается дальнейшей переработке для получения биологически активной формы. Идентифицировано несколько альтернативно сплайсированных вариантов транскриптов. Аутотаксин способен расщеплять фосфодиэфирную связь между α и β положениями трифосфатных нуклеотидов, действуя как эктонуклеотидфосфодиэстераза, продуцирующая пирофосфат, как и большинство членов семейства ENPP. Важно отметить, что аутотаксин также действует как фосфолипаза, катализируя удаление головной группы различных лизолипидов.
Физиологическая функция аутотаксина — выработка сигнального липида лизофосфатидовой кислоты (ЛФК) во внеклеточных жидкостях. ЛФК вызывает реакции, подобные факторам роста, включая стимуляцию пролиферации клеток и хемотаксиса. Этот генный продукт стимулирует подвижность опухолевых клеток, обладает ангиогенными свойствами, а его экспрессия повышается в некоторых типах опухолей[6]. Кроме того, аутотаксин и ЛФК вовлечены в многочисленные воспалительные заболевания, такие как астма и артрит[7]. Физиологически ЛФК способствует реакции заживления ран при повреждении тканей. В нормальных условиях ЛФК негативно регулирует транскрипцию аутотаксина, но в контексте заживления ран цитокины индуцируют экспрессию аутотаксина, увеличивая общую концентрацию ЛФК[8].
Было показано, что функция аутотаксина может регулироваться на его аллостерическом участке определёнными стероидами, а именно желчными кислотами[9] или его собственным продуктом, лизофосфатидной кислотой[10].
Как мишень для лекарств
Для клинического применения разработаны различные низкомолекулярные ингибиторы аутотаксина. Специфический ингибитор идиопатического фиброза легких показал многообещающие результаты в испытании фазы II, которое закончилось в мае 2018 г.[11] Также был описан ингибитор аутотаксина ДНК-аптамер[12].
Структура
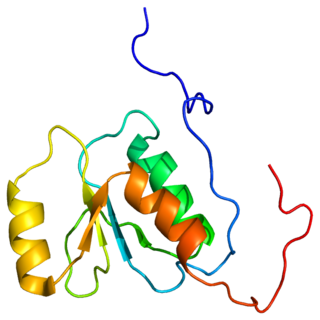
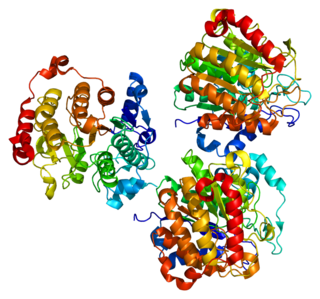
Кристаллические структуры аутотаксина крысы[13] и мыши[14] были решены. В каждом случае структура апо была решена вместе с комплексами, связанными с продуктом или ингибитором. Оба белка состоят из 4-х доменов, 2-х N-концевых соматомедин-B-подобных доменов (СМВ), которые могут участвовать в локализации на клеточной поверхности. Каталитический домен следует за ним и содержит глубокий гидрофобный карман, в котором связывается липидный субстрат. На С-конце находится неактивный домен нуклеазы, который может действовать, чтобы способствовать стабильности белка.
См. также
Примечания
- ↑ 1 2 3 GRCh38: Ensembl release 89: ENSG00000136960 - Ensembl, May 2017
- ↑ 1 2 3 GRCm38: Ensembl release 89: ENSMUSG00000022425 - Ensembl, May 2017
- ↑ Ссылка на публикацию человека на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Ссылка на публикацию мыши на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ "Molecular cloning and chromosomal assignment of the human brain-type phosphodiesterase I/nucleotide pyrophosphatase gene (PDNP2)". Genomics. 30 (2): 380—4. November 1995. doi:10.1006/geno.1995.0036. PMID 8586446.
- ↑ 1 2 Entrez Gene: ENPP2 ectonucleotide pyrophosphatase/phosphodiesterase 2 (autotaxin).
- ↑ "Autotaxin in the crosshairs: taking aim at cancer and other inflammatory conditions". FEBS Letters. 588 (16): 2712—27. August 2014. doi:10.1016/j.febslet.2014.02.009. PMID 24560789.
- ↑ "Regulation of autotaxin expression and secretion by lysophosphatidate and sphingosine 1-phosphate". Journal of Lipid Research. 56 (6): 1134—44. June 2015. doi:10.1194/jlr.M057661. PMID 25896349.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "Steroid binding to Autotaxin links bile salts and lysophosphatidic acid signalling". Nature Communications. 7: 11248. April 2016. doi:10.1038/ncomms11248. PMID 27075612.
- ↑ "Lysophosphatidic acid produced by Autotaxin acts as an allosteric modulator of its catalytic efficiency". Journal of Biological Chemistry. 293 (37): 14312—14327. July 2018. doi:10.1074/jbc.RA118.004450. PMID 30026231.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Clinical trial number NCT02738801 for "Study to Assess Safety, Tolerability, Pharmacokinetic and Pharmacodynamic Properties of GLPG1690" at ClinicalTrials.gov
- ↑ "Structural basis for specific inhibition of Autotaxin by a DNA aptamer". Nature Structural & Molecular Biology. 23 (5): 395—401. May 2016. doi:10.1038/nsmb.3200. PMID 27043297.
- ↑ "Structural basis of substrate discrimination and integrin binding by autotaxin". Nature Structural & Molecular Biology. 18 (2): 198—204. February 2011. doi:10.1038/nsmb.1980. PMID 21240271.
- ↑ "Crystal structure of autotaxin and insight into GPCR activation by lipid mediators". Nature Structural & Molecular Biology. 18 (2): 205—12. February 2011. doi:10.1038/nsmb.1998. PMID 21240269.
Дальнейшее чтение
- Perrakis A, Moolenaar WH (June 2014). "Autotaxin: structure-function and signaling". Journal of Lipid Research. 55 (6): 1010—8. doi:10.1194/jlr.r046391. PMC 4031933. PMID 24548887.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - Tokumura A, Majima E, Kariya Y, Tominaga K, Kogure K, Yasuda K, Fukuzawa K (October 2002). "Identification of human plasma lysophospholipase D, a lysophosphatidic acid-producing enzyme, as autotaxin, a multifunctional phosphodiesterase". The Journal of Biological Chemistry. 277 (42): 39436—42. doi:10.1074/jbc.M205623200. PMID 12176993.
- Umezu-Goto M, Kishi Y, Taira A, Hama K, Dohmae N, Takio K, Yamori T, Mills GB, Inoue K, Aoki J, Arai H (July 2002). "Autotaxin has lysophospholipase D activity leading to tumor cell growth and motility by lysophosphatidic acid production". The Journal of Cell Biology. 158 (2): 227—33. doi:10.1083/jcb.200204026. PMC 2173129. PMID 12119361.
- Stracke ML, Krutzsch HC, Unsworth EJ, Arestad A, Cioce V, Schiffmann E, Liotta LA (February 1992). "Identification, purification, and partial sequence analysis of autotaxin, a novel motility-stimulating protein". The Journal of Biological Chemistry. 267 (4): 2524—9. doi:10.1016/S0021-9258(18)45911-X. PMID 1733949.
- Stracke ML, Arestad A, Levine M, Krutzsch HC, Liotta LA (August 1995). "Autotaxin is an N-linked glycoprotein but the sugar moieties are not needed for its stimulation of cellular motility". Melanoma Research. 5 (4): 203—9. doi:10.1097/00008390-199508000-00001. PMID 7496154.
- Murata J, Lee HY, Clair T, Krutzsch HC, Arestad AA, Sobel ME, Liotta LA, Stracke ML (December 1994). "cDNA cloning of the human tumor motility-stimulating protein, autotaxin, reveals a homology with phosphodiesterases". The Journal of Biological Chemistry. 269 (48): 30479—84. doi:10.1016/S0021-9258(18)43838-0. PMID 7982964.
- Lee HY, Murata J, Clair T, Polymeropoulos MH, Torres R, Manrow RE, Liotta LA, Stracke ML (January 1996). "Cloning, chromosomal localization, and tissue expression of autotaxin from human teratocarcinoma cells". Biochemical and Biophysical Research Communications. 218 (3): 714—9. doi:10.1006/bbrc.1996.0127. PMID 8579579.
- Lee HY, Clair T, Mulvaney PT, Woodhouse EC, Aznavoorian S, Liotta LA, Stracke ML (October 1996). "Stimulation of tumor cell motility linked to phosphodiesterase catalytic site of autotaxin". The Journal of Biological Chemistry. 271 (40): 24408—12. doi:10.1074/jbc.271.40.24408. PMID 8798697.
- Clair T, Lee HY, Liotta LA, Stracke ML (January 1997). "Autotaxin is an exoenzyme possessing 5'-nucleotide phosphodiesterase/ATP pyrophosphatase and ATPase activities". The Journal of Biological Chemistry. 272 (2): 996—1001. doi:10.1074/jbc.272.2.996. PMID 8995394.
- Dias Neto E, Correa RG, Verjovski-Almeida S, Briones MR, Nagai MA, da Silva W, Zago MA, Bordin S, Costa FF, Goldman GH, Carvalho AF, Matsukuma A, Baia GS, Simpson DH, Brunstein A, de Oliveira PS, Bucher P, Jongeneel CV, O'Hare MJ, Soares F, Brentani RR, Reis LF, de Souza SJ, Simpson AJ (March 2000). "Shotgun sequencing of the human transcriptome with ORF expressed sequence tags". Proceedings of the National Academy of Sciences of the United States of America. 97 (7): 3491—6. doi:10.1073/pnas.97.7.3491. PMC 16267. PMID 10737800.
- Nam SW, Clair T, Kim YS, McMarlin A, Schiffmann E, Liotta LA, Stracke ML (September 2001). "Autotaxin (NPP-2), a metastasis-enhancing motogen, is an angiogenic factor". Cancer Research. 61 (18): 6938—44. PMID 11559573.
- Umezu-Goto M, Kishi Y, Taira A, Hama K, Dohmae N, Takio K, Yamori T, Mills GB, Inoue K, Aoki J, Arai H (July 2002). "Autotaxin has lysophospholipase D activity leading to tumor cell growth and motility by lysophosphatidic acid production". The Journal of Cell Biology. 158 (2): 227—33. doi:10.1083/jcb.200204026. PMC 2173129. PMID 12119361.
- Tokumura A, Majima E, Kariya Y, Tominaga K, Kogure K, Yasuda K, Fukuzawa K (October 2002). "Identification of human plasma lysophospholipase D, a lysophosphatidic acid-producing enzyme, as autotaxin, a multifunctional phosphodiesterase". The Journal of Biological Chemistry. 277 (42): 39436—42. doi:10.1074/jbc.M205623200. PMID 12176993.
- Jung ID, Lee J, Yun SY, Park CG, Choi WS, Lee HW, Choi OH, Han JW, Lee HY (December 2002). "Cdc42 and Rac1 are necessary for autotaxin-induced tumor cell motility in A2058 melanoma cells". FEBS Letters. 532 (3): 351—6. doi:10.1016/S0014-5793(02)03698-0. PMID 12482591.
- Yang SY, Lee J, Park CG, Kim S, Hong S, Chung HC, Min SK, Han JW, Lee HW, Lee HY (2003). "Expression of autotaxin (NPP-2) is closely linked to invasiveness of breast cancer cells". Clinical & Experimental Metastasis. 19 (7): 603—8. doi:10.1023/A:1020950420196. PMID 12498389.
- Gijsbers R, Aoki J, Arai H, Bollen M (March 2003). "The hydrolysis of lysophospholipids and nucleotides by autotaxin (NPP2) involves a single catalytic site". FEBS Letters. 538 (1—3): 60—4. doi:10.1016/S0014-5793(03)00133-9. PMID 12633853.
- Koh E, Clair T, Woodhouse EC, Schiffmann E, Liotta L, Stracke M (May 2003). "Site-directed mutations in the tumor-associated cytokine, autotaxin, eliminate nucleotide phosphodiesterase, lysophospholipase D, and motogenic activities". Cancer Research. 63 (9): 2042—5. PMID 12727817.
- Kehlen A, Englert N, Seifert A, Klonisch T, Dralle H, Langner J, Hoang-Vu C (May 2004). "Expression, regulation and function of autotaxin in thyroid carcinomas". International Journal of Cancer. 109 (6): 833—8. doi:10.1002/ijc.20022. PMID 15027116.
- Boucher J, Quilliot D, Pradères JP, Simon MF, Grès S, Guigné C, Prévot D, Ferry G, Boutin JA, Carpéné C, Valet P, Saulnier-Blache JS (March 2005). "Potential involvement of adipocyte insulin resistance in obesity-associated up-regulation of adipocyte lysophospholipase D/autotaxin expression". Diabetologia. 48 (3): 569—77. doi:10.1007/s00125-004-1660-8. PMC 1885462. PMID 15700135.
- van Meeteren LA, Ruurs P, Christodoulou E, Goding JW, Takakusa H, Kikuchi K, Perrakis A, Nagano T, Moolenaar WH (June 2005). "Inhibition of autotaxin by lysophosphatidic acid and sphingosine 1-phosphate". The Journal of Biological Chemistry. 280 (22): 21155—61. doi:10.1074/jbc.M413183200. PMID 15769751.