Ацетаты
Ацетаты (от лат. Acidum aceticum) — два больших разных класса производных уксусной кислоты: соли уксусной кислоты и сложные эфиры уксусной кислоты. Ацетаты получаются при замене водорода (H+) карбоксильной группы уксусной кислоты на:
- щелочные металлы (Na+ с образованием соли ацетата натрия CH3COONa), щелочноземельные ( Ca2+ → ацетат кальция (CH3COO)2Ca), переходные металлы ( Fe3+ → ацетат железа Fe(CH3COO)3);
- неметаллы ( NH4+ → ацетат аммония CH3COONH4; Si4+ → тетраацетат кремния Si(CH3COO)4, использующегося как окислитель[1];
- радикалы c образованием сложных эфиров (например с радикалом (СН3–) образуется метилацетат или метиловый эфир уксусной кислоты CH3COOCH3).
Замена водорода не происходит простой реакцией замещения.
Анион CH3COO- называется ацетат-ионом[2].
Ацетатная группа с химической формулой CH3CO и структурной формулой -C(=O)-CH3 может обозначаться символом Ас[3], что может вносить путаницу из-за такого-же обозначения элемента актиния, тогда ацетат натрия будет записан, как AcONa, а этилацетат как EtOAc[4].
Ацетаты в виде солей — кристаллические продукты, хорошо растворимые в воде; эфиры — летучие жидкости с фруктовым и цветочным запахом. Ацетаты применяют как растворители для лаков, смол, в производстве целлулоида, в парфюмерии и пищeвой промышленности. Большая часть ацетатов, производимых в промышленности, имеет форму полимеров. В биосинтезе ацетаты наиболее распространённый строительный элемент.
Физические свойства
Соли уксусной кислоты хорошо растворяются в воде[5], исключением являются ацетаты серебра и ртути(I) довольно плохо растворяющиеся в холодной воде[6]. Ацетаты- соли легко кристаллизуются[6].
Ацетаты-соли, в том числе и ацетаты щелочных и щелочно-земельных металлов, образуют двойные и комплексные соединения. При связывании ацетатами-солями молекул уксусной кислоты получаются так называемые кислые ацетаты, например кислый ацетат натрия Na(CH3COO)·2СH3COOH[6]. Переходные металлы могут образовывать комплексы, например ацетат хрома (II) и осно́вный ацетат цинка.
Ацетаты в виде эфиров — летучие жидкости с фруктовым и цветочным запахом[7]. Сложные эфиры уксусной кислоты служат хорошими органическими растворителями, но горючи и огнеопасны[7]. Активные растворители ацетаты-сложные эфиры, используемые, например, для производства нитролаков, разделяются по температуре кипения на[8]:
- высококипящие (бутилацетат, изобутилацетат, амилацетат);
- низкокипящие (этилацетат, пропилацетат).
Получение
Ацетаты-соли уксусной кислоты получают растворением оксидов, гидроксидов или некоторых солей (например, карбонатов) в уксусной кислоте.
Ацетат натрия можно приготовить, как шипучку (газированная вода), в домашних условиях из уксуса и соды по реакции:
CH3COOH + NaHCO3 → CH3COO - Na + + H2O + CO2
Ацетаты-сложные эфиры уксусной кислоты получают по реакции этерификации уксусной кислоты или уксусного ангидрида со спиртами[9]:
CH3COOH + ROH = CH3COOR + H2O, где R— радикал
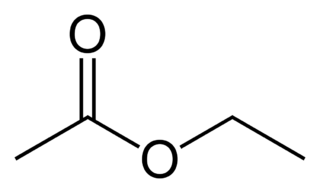
Если радикал R = C2H5+,то получается этилацетат по реакции[9]:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Химические свойства ацетатов- солей уксусной кислоты
Взаимодействие с кислотами
Под действием нелетучих кислот из ацетатов-солей выделяется уксусная кислота[6].
Ацетаты-соли (например ацетат кальция) способны к декарбоксилированию уксусной кислоты с образованием ацетона[10].
Гидролиз
Водные растворы ацетатов— солей уксусной кислоты, образованных сильными основаниями (катионы щелочных металлов Na,K и щелочно-земельных металлов Ba и т.д.), имеют щелочную реакцию[11].
Соли уксусной кислоты (ацетаты) переходных металлов подвергаются гидролизу с образованием гидроксида металла и осно́вных ацетатов по реакциям[5]:
Fe(CH3COO)3 + H2O = Fe(OH)(C2H3O2)2 + CH3COOH
Fe(C2H3O2)3 + 2H2O = Fe(OH)2(C2H3O2) + 2CH3COOH
Fe(C2H3O2)3 + 3H2O = Fe(OH)3 + 3CH3COOH
Красно-бурый осадок это осно́вный ацетат железа Fe(OH)2(C2H3O2).
В случае гидролиза ацетата аммония CH3COONH4, как соли слабой кислоты и слабого основания, раствор сохраняет нейтральную реакцию[11].
На гидролизе солей уксусной кислоты (ацетатов) основано протравное крашение тканей[12]:
- ткань пропитывается ацетатом (например ацетатом алюминия, железа, хрома),
- обрабатывается паром,
- на волокне образуется гидроксид металла вследствие реакций гидролиза, прочно связанный с тканью
- краситель связывается с металлом, благодаря металлу формируя прочное окрашивание.
Гидролитический метод осаждения
При анализе руд, шлаков, сплавов, когда стоит задача отделения алюминия и железа от марганца, никеля, кобальта, цинка, в качестве одного из методов разделения отдельных катионов (например Fe3+) или их групп ( например Al3++Fe3+ ) используется метод их осаждение при помощи ацетатов (например, ацетата натрия CH3COONa, как соли слабой уксусной кислоты) с получением красно-бурых осадков в виде гидроксидов или осно́вных ацетатов (например Fe(OH)2(C2H3O2) в виде красно-бурого осадка)[13]. Для железа этот метод — количественный[13].
Лабораторный метод получения метана
Сплавление ацетатов с едкими щелочами является наиболее простым лабораторным методом получения метана[14].
Электролиз
При электролизе ацетатов щелочных металлов в водных или метанольных растворах на аноде образуется этан[15].
Качественные реакции
Качественные реакции на металлы в ацетатах-солях уксусной кислоты основаны на выпадении в осадок гидроксидов металлов или осно́вных ацетатов разного цвета.
Качественной реакцией на ацетаты-сложные эфиры является реакция омыления[16].
Качественными реакциями на ацетат-группу служат:
- реакция с серной кислотой с появлением запаха уксуса вследствие образования уксусной кислоты[17];
- реакция с хлоридом железа(III) с выпадением красно-бурого осадка Fe(OH)2(C2H3O2)[17];
- реакция с изо-амиловым спиртом с появление запаха грушевой эссенции вследствие образования амил-ацетата[16][17];
- реакция с этиловым спиртом с появлением фруктового запаха этилацетата[16][17];
- реакция с трехокисью мышьяка As2O3 с появлением отвратительного запаха какодила из-за образования окиси какодила (CH3)2As−O−As(CH3)2 при воздействии на ацетатную группу. За мерзкий запах ответственен радикал (СН3)2As−, названный какодил (от греч. κᾰκός «дурной»)[16].
Ацетаты — сложные эфиры уксусной кислоты
Ацетаты — сложные эфиры уксусной кислоты с общей формулой CH3CO2R, где R — радикалы, заменяющие водород (H+) карбоксильной группы уксусной кислоты. Сложные эфиры доминируют на рынке ацетатов. Обычно малотоксичны. В качестве радикалов могут выступать:
- углеводородные остатки алканов, образующие, например, CH3COOCH3 метилацетат (метиловый эфир уксусной кислоты ), CH3COOC2H5 этилацетат (этиловый эфир уксусной кислоты, фруктовый запах);
- углеводородные остатки алкенов, образующие, например, CH3COOCH=СН2 винилацетат[18], который является сырьём для производства поливинилового спирта, входящего в состав многих красок;
- углеводородные остатки ароматических соединений, например ацетилцеллюлоза (ацетат целлюлозы) — сложный эфир целлюлозы и уксусной кислоты и другие.
Ацетаты — сложные эфиры уксусной кислоты чаще других используются в качестве душистых веществ[9].
Запахи зависят от структуры ацетатов — сложных эфиров уксусной кислоты[9]:
- фруктовые и фруктово-ягодные запахи имеют ацетаты низших алифатических спиртов, использующиеся в качестве пищевых эссенций с фруктовым запахом (этилацетат);
- цветочные запахи имеют ацетаты терпеновых спиртов, применяемых в парфюмерии и производстве синтетических моющих средств;
- запах цветов, фруктов и зелени имеют ацетаты ароматических спиртов.
В биологии
Ацетат-ион — распространенный анион в биохимии, с помощью которого синтезируется ацетил-КоА(подробности[19]), доставляющий атомы углерода с ацетил-группой в цикл трикарбоновых кислот, для их окисления с выделением энергии.
Сложный эфир уксусной кислоты и холина, так называемый нейромедиатор ацетилхолин, участвует в передаче нервного импульса, синтезируясь в нервной клетке из ацетилкоэнзима А[20].
Ацетаты иногда являются побочным продуктом молочнокислого брожения. В ходе брожения, вызываемого бифидобактериями, — бифидоброжения, из глюкозы образуются ацетат и лактат:
2С6Н12О6 = ЗСН3СООН + 2СН3СНОНСООН
Предполагается, что причиной алкогольного похмелья является ацетат, образующийся в организме при окислении спирта[21][22].
Применение
С давних времён был известен очень ядовитый уксуснокислый свинец, так называемый свинцовый сахар Pb(CH3COO)2·3H2O, применяемый до сих пор при производстве свинцовых белил[5]. Основной уксуснокислый свинец Pb(OH)2· Pb(CH3 COO), так называемый «свинцовый уксус» или «свинцовая примочка», ранее широко применялся в медицине[5]. Основная уксуснокислая медь, известная как «ярь-медянка», использовалась как зелёная краска, а соединение уксуснокислой меди с мышьяковистокислой медью Cu(CH3COO)2·3Cu(AsO2)2, так называемая парижская зелень, использовалась как инсектицид[5]. Из солей уксусной кислоты к середине XX веке наибольшее применение находили соли железа, алюминия и хрома, применяемые в качестве протравы при крашении тканей[5]. Коммерчески важным является ацетат аммония как предшественник ацетамида CH3CONH2, ацетат калия как мочегонное средство. Огромное значение имеет ацетат натрия для тонкого органического синтеза[23]. Метилацетат используется как промышленный растворитель. Ацетилцеллюлоза используется в производстве ацетатных волокон и была важной компонентой в производстве грампластинок. Винилацетат является сырьём для поливинилового спирта, входящего в состав красок, также из сополимеров винилацетата изготавливается универсальный полимерный клей.
См. также
- Ацетатные волокна
- 1-Ацетоксибутадиен-1,3
- Ацетат диамминмеди(II)
- Ацетат кобальта(III)
- Ацетат нептунила-натрия
- Ацетат олова(IV)
- Ацетат олова(II)
- Ацетат плутонила-натрия
Литература
- Ацетаты // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2004. — Т. I. — ISBN 9965-9389-9-7. (CC BY-SA 3.0)
Ссылки
Примечания
- ↑ Лабораторные работы по органической химии / под ред. Гинзбурга О.Ф., Петрова А.А.. — М.: Высшая школа, 1970. — С. 129, 134. — 296 с. Архивировано 30 августа 2020 года.
- ↑ Ацетат-ион. Большая энциклопедия нефти и газа. Дата обращения: 10 октября 2022. Архивировано 10 октября 2022 года.
- ↑ James Ralph Hanson. Functional Group Chemistry (англ.). — Cambridge: Royal Society of Chemistry, 2001. — P. 11. — ISBN 0854046275. Архивировано 10 октября 2022 года.
- ↑ Steven S. Zumdahl. Chemistry (англ.). — Lexington, Mass.: Heath, 1986. — ISBN 0-669-04529-2. Архивировано 10 октября 2022 года.
- ↑ 1 2 3 4 5 6 Борис Алексеевич Павлов, Александр Петрович Терентьев. Курс органической химии. — М.: Химия, 1965. — С. 232. — 686 с.
- ↑ 1 2 3 4 Г.Реми. Курс неорганической химии / под ред. чл-корр. АН СССР А.В.Новосёловой. — М.: Иностранная литература, 1963. — С. 496. Архивировано 9 июля 2020 года.
- ↑ 1 2 Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. — М.: Химия, 1971. — С. 263. — 840 с. Архивировано 17 мая 2020 года.
- ↑ Лившиц М.Л., Пшиялковский Б.И. Лакокрасочные материалы. — М.: Химия, 1982. — С. 255. — 360 с.
- ↑ 1 2 3 4 Братус И.Н. Химия душистых веществ. — М.: Агропромиздат, 1992. — С. 93. — 240 с.
- ↑ Р.Гольдштейн. Химическая переработка нефти / под ред. акад. АН Арм. ССР проф. В.И.Исагулянца. — М.: Издательство иностранной литературы, 1961. — С. 317.
- ↑ 1 2 Гольбрайх З.Е. Сборник задач и упражнений по химии. — М.: Высшая школа, 1984. — С. 130. — 224 с. Архивировано 13 октября 2022 года.
- ↑ Писаренко А.П., Хавин З.Я. Курс органической химии. — М.: Высшая школа, 1968. — С. 409.
- ↑ 1 2 А.К.Бабко, И.В.Пятницкий. Количественный анализ. — М.: Высшая школа, 1962. — С. 97.
- ↑ В.Г.Жиряков. Органическая химия. — М.: Химия, 1964. — С. 40.
- ↑ Ф.М.Рапопорт, А.А.Ильинская. Лабораторные методы получения чистых газов. — М.: Госхимиздат, 1963. — С. 314. — 420 с.
- ↑ 1 2 3 4 Петрова Л.Н., Зеленецкая А.А., Скворцова А.Б. Анализ синтетических душистых веществ и эфирных масел. — М.: Пищевая промышленность, 1972. — С. 298.
- ↑ 1 2 3 4 Логинов Н.Я. и др. Аналитическая химия. — М.: Просвещение, 1975. — С. 249. — 478 с.
- ↑ Эпштейн Д.А. Общая химическая технология: учебник для ПТУ. — М.: Химия, 1979. — С. 266. — 312 с.
- ↑ У.Уотерс. Механизм окисления органических соединений / под ред. академика Несмеянова А.Н.. — М.: Мир, 1966. — С. 124.
- ↑ Березов Т.Т., Коровкин Б.Ф. Биологическая химия. — М.: Медицина, 1998. — С. 638. — 704 с. — ISBN 5-225-02709-1.
- ↑ Christina R. Maxwell,Rebecca Jay Spangenberg,Jan B. Hoek,Stephen D. Silberstein,Michael L. Oshinsky. Acetate Causes Alcohol Hangover Headache in Rats (англ.) // PLOS ONE. — 2010. — December (no. 5). — doi:10.1371/journal.pone.0015963. Архивировано 15 октября 2022 года.
- ↑ Bob Holmes. Is coffee the real cure for a hangover? (англ.). https://www-newscientist-com (11 января 2011). Дата обращения: 10 октября 2022. Архивировано 10 октября 2022 года.
- ↑ Белоцветов А.В., Бесков С.Д., Ключников Н.Г. Химическая технология. — М.: Просвещение, 1976. — С. 251. — 319 с.