Ацетоин
| Ацетоин | |||
|---|---|---|---|
| |||
| Общие | |||
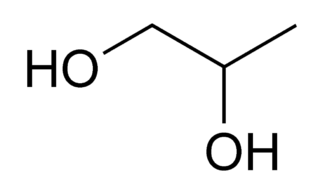
| Систематическое наименование | З-гидрокси-2-бутанон | ||
| Традиционные названия | ацетоин | ||
| Хим. формула | C4H8O2 | ||
| Физические свойства | |||
| Состояние | жидкость/твёрдое вещество | ||
| Молярная масса | 88,106 г/моль | ||
| Плотность | 1,012 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 15 °C | ||
| • кипения | 148 °C | ||
| • вспышки | 41 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 13,72 | ||
| Растворимость | |||
| • в воде | 100 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1.4171 | ||
| Классификация | |||
| Рег. номер CAS | 513-86-0 | ||
| PubChem | 179 | ||
| Рег. номер EINECS | 208-174-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | EL8790000 | ||
| ChEBI | 15688 | ||
| ChemSpider | 21105851 | ||
| Безопасность | |||
| ЛД50 | > 5000 мг/кг, крысы перорально | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
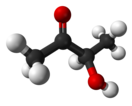
Ацетоин (ацетилметилкарбинол, З-гидрокси-2-бутанон) — вещество, являющееся простейшим представителем ацилоинов.
Физические свойства
Ацетоин представляет собой бесцветную или жёлтую жидкость (т. пл. 15 °C) с сильным маслянисто-сливочным запахом. Растворим в спиртах, смешивается с пропиленгликолем. Слабо растворим в петролейном и диэтиловом эфире. Может существовать в форме мономера или димера. Товарный продукт, используемый в промышленности, чаще всего представляет собой димер.
Получение
(R)-ацетоин является одним из продуктов бутандиолового брожения (родов Escherichia, Erulinia, Serrata).
В лаборатории может быть получен восстановлением ацетоуксусного эфира натрием в ксилоле[1].
При облучении водного раствора ацетальдегида и пировиноградной кислоты ультрафиолетом ацетоин образуется с количественным выходом[2].
Также ацетоин может быть получен из нитрила молочной кислоты и йодистого метилмагния[3].

Применение
Применяется в производстве пищевых ароматизаторов. Содержится в сливочном масле, вине, кофе. Также применяется в жидкостях для электронных сигарет для придания масляного или карамельного аромата.[4]
Литература
Войткевич С. А. 1.67 // 865 душистых веществ для парфюмерии и бытовой химии. — М.: Пищевая промышленность, 1994.
Примечания
- ↑ Органические реакции. Сборник 4. Москва, Иностранная литература, 1951, стр. 226—227
- ↑ Dirsherl, Zeitschrift für Physiologische Chemie, 188, 225 (1930)
- ↑ А. Мэррей, Д. Л. Уильямс. Синтезы органических соединений с изотопами углерода. Часть II. М., ИЛ., 1962, стр. 47
- ↑ Committee on the Review of the Health Effects of Electronic Nicotine Delivery Systems, National Academies of Sciences. Chapter 5: Toxicology of E-Cigarette Constituents // Public Health Consequences of E-Cigarettes : [англ.]. — National Academies Press, 2018. — P. 175. — ISBN 9780309468343.