Углеводоро́ды — органические соединения, молекулы которых включают только атомы углерода и водорода.

Моле́кула — электрически нейтральная частица, образованная из двух или более связанных атомов.

Органи́ческая хи́мия — раздел химии, изучающий структуру, свойства и методы синтеза соединений углерода с другими химическими элементами, относящихся к органическим соединениям. Первоначальное значение термина органическая химия подразумевало изучение только соединений углерода растительного и животного происхождения. По этой причине ряд углеродсодержащих соединений традиционно не относят к органическим, а рассматривают как неорганические соединения. Условно можно считать, что структурным прототипом органических соединений являются углеводороды.

Углеро́д — химический элемент четырнадцатой группы второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 6.
Изомери́я — явление, заключающееся в существовании химических соединений — изомеров, — одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Химическая связь — взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами. Современное описание химической связи проводится на основе квантовой механики. Основные характеристики химической связи — прочность, длина, полярность, устойчивость.

Циклоалка́ны (также полиметиленовые углеводороды, нафтены, цикланы, или циклопарафины) — циклические насыщенные углеводороды, относятся к насыщенным карбоциклическим соединениям. Могут содержать боковые цепи, содержащие углеводородные (алкильные) заместители, соединенные с циклом. Все атомы углерода циклоалканов находятся в sp3-гибридизированном состоянии. Моноциклические (содержащие один цикл) циклоалканы образуют гомологические ряды с общей формулой CnH2n. Простейшим циклоалканом является циклопропан(цикло-С3H6). По числу атомов углерода в цикле циклоалканы делят на малые – циклопропан и циклобутан, обычные – циклопентан, циклогексан и циклогептан, средние – от циклооктана (8 атомов углерода) до циклододекана (12 атомов углерода), большие – с 13 и более атомами в карбоцикле.

Иоганн Фридрих Вильгельм Адольф фон Ба́йер — немецкий химик-органик, лауреат Нобелевской премии по химии 1905 года.
Пропи́л (C3H7•) — одновалентный радикал пропана СН3СН2СН3. Как видно, атомы углерода в пропане не эквивалентны, точнее, их два вида. Это приводит к возможности образования двух типов пропильных радикалов: CH3CH2CH2• (1-пропил или н-пропил, то есть «нормальный» пропил, обозначается как n-Pr) и (CH3)2CH• (2-пропил или изопропил, обозначается как i-Pr).

Гибридиза́ция орбита́лей — процесс смешения различных атомных орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим правилам. Угол между гибридными орбиталями при sp3-гибридизации равен 109.5°, при sp2 — 120°, при sp — 180°.
Алициклические соединения — органические соединения, молекулы которых содержат насыщенные или ненасыщенные неароматические циклы, состоящие из атомов углерода. Алициклические соединения вместе с ароматическими соединениями, не содержащими гетероатомов в цикле, составляют класс изоциклических или карбоциклических соединений. Алициклические соединения классифицируют по числу атомов в кольце, по числу колец, по наличию или отсутствию кратных связей. В алициклических соединениях различают изомерию циклов, изомерию боковых цепей и расположение их в циклах, стереоизомерию. Алициклические соединения — важные модели для развития конформационного анализа. Входят в состав нефти, эфирных масел, стеринов, стероидов, антибиотиков и других веществ природного происхождения. Применяют в качестве компонентов топлива, инсектицидов, лекарственных средств, полупродуктов в производстве синтетических волокон.

Циклобутан (тетраметилен), C4H8 — углеводород алициклического ряда.
Структурная химия — раздел, область химии, изучающая связь различных физических и физико-химических свойств различных веществ с их химическим строением и реакционной способностью. Структурная химия рассматривает не только геометрическое строение молекул; изучению подвергается следующее — длины химических связей, валентные углы, координационные числа, конформации и конфигурации молекул; эффекты их взаимного влияния, ароматичность.

Пи-связь (π-связь) — ковалентная связь, образующаяся перекрыванием атомных p-орбиталей. В отличие от сигма-связи, осуществляемой перекрыванием s-орбиталей вдоль линии соединения атомов, пи-связи возникают при перекрывании p-орбиталей по обе стороны от линии соединения атомов. Считается, что пи-связь реализуется в кратных связях — двойная связь состоит из одной сигма- и одной пи-связи, тройная — из одной сигма- и двух ортогональных пи-связей.

Теория валентных связей — приближённый квантовохимический расчётный метод, основанный на представлении о том, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.

Электронная теория химической связи была предложена и развита американским физикохимиком Льюисом Г.Н в 1912—1916 гг. Ковалентная химическая связь, по Льюису, образуется за счёт обобществления пары электронов, то есть электронная плотность распределяется между двумя атомами, в противовес господствующей в то время теории, будто один из связанных атомов несёт положительный, а другой отрицательный заряд. Льюис также предложил обозначать электроны точками у символа химического элемента. Электронная теория химической связи включает идею Льюиса, что завершённый внешний электронный слой атома содержит восемь электронов.

Тройная связь — ковалентная связь двух атомов в молекуле посредством трёх общих связывающих электронных пар.
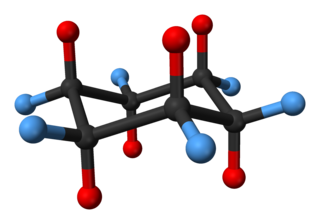
Конформация циклогексана — одна из нескольких трёхмерных форм, принимаемой молекулой циклогексана. Поскольку многие соединения имеют похожие шестиатомные циклы, изучение структуры и свойств циклогексана важны для понимания свойств широкого спектра молекул.

Циклопропе́н — органическое соединение, циклический углеводород с молекулярной формулой C3H4. Это трёхуглеродное соединение является самым простым циклоалкеном. Производные циклопропена присутствуют в некоторых жирных кислотах, используются для контроля созревания определённых плодов.
В химии, молекула испытывает напряжение, когда её химическая структура подвергается некоторой деформации, вызванной действием внутренних сил, которая ведёт к увеличению внутренней энергии по сравнению с эталонным соединением без деформаций. Внутренняя энергия молекулы состоит из суммы всех энергий, «запасенных» внутри неё. Отдельно взятая форма напряженной молекулы, отличающаяся от всех других называется конформером. Напряженная молекула имеет дополнительную энергию, которую не имеет ненапряженное соединение. Эту дополнительную энергию, или энергию напряжения, можно сравнить со сжатой пружиной. Точно также, как сжатая пружина должна удерживаться на месте, чтобы не дать высвободиться своей потенциальной энергии, молекула может удерживаться в энергетически невыгодной конформации за счет химических связей внутри нее. Без этих химических связей, удерживающих конформер на месте, энергия напряжения сразу бы высвободилась.













