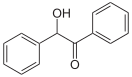
Бензоин
| Бензоин | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | 2-гидрокси-1,2-дифенилэтан-1-он | ||
| Традиционные названия | 2-гидрокси-2-фенилацетонон 2-гидрокси-1,2-дифенилэтанон Дезиловый спирт Горькое миндальное масло камфоры | ||
| Хим. формула | C14H12O2 | ||
| Физические свойства | |||
| Состояние | белесые кристаллы | ||
| Молярная масса | 212.25 г/моль | ||
| Плотность | 1.31 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 132-137 °C | ||
| • кипения | 344 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | малорастворимо | ||
| • в этаноле | малорастворимо | ||
| • в спиртах | Растворяется | ||
| • в эфирах | малорастворимо | ||
| • в хлоре | растворяется | ||
| Классификация | |||
| Рег. номер CAS | 119-53-9 | ||
| PubChem | 8400 | ||
| Рег. номер EINECS | 204-331-3 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 17682 | ||
| ChemSpider | 8093 | ||
| Безопасность | |||
| ЛД50 | 10.000 мг/кг | ||
| Меры предостор. (P) | R36/38 [1] | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бензои́н — 2-гидрокси-1,2-дифенилэтан-1-он, простейшиий представитель ароматических ацилоинов - бензоинов. органическое соединение с формулой PhCH(OH)C(O)Ph. Бесцветные кристаллы с легким запахом камфоры.
Карбинольный атом углерода бензоина хирален, бензоин является рацематом - смесью энантиомеров: (R)-бензоина и (S)-бензоина.
История
Бензоин впервые описан в 1832 году Юстусом фон Либихом и Фридрихом Вёлером, он синтезировал его в ходе своих исследований масла горького миндаля, которое представляет собой бензальдегид со следами синильной кислоты[2]. Именно примесь синильной кислоты в бензальдегиде позволила Либиху и Вёлеру совершить синтез бензоина, т.к. цианид-ион является катализатором образования бензоина из бензальдегида. Во время своей работы с Либихом Николай Зинин усовершенствовал каталитическую бензоиновую конденсацию[3][4].
Впоследствии эта реакция была обобщена и на другие ароматические альдегиды и получила название бензоиновой конденсации.
Синтез
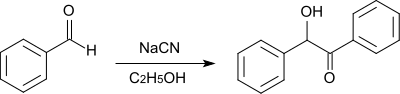
Бензоин синтезируют из бензальдегида кипячением в этаноле в присутствии цианида натрия, выход составляет 90–92%[5].
Для очистки бензоин перекристаллизовывают из 95% этанола.
Бензоин также может быть синтезирован конденсацией бензола и фенилглиоксаля в присутствии хлорида алюминия с выходом 90%[6], этот метод для синтеза самого бензоина не используется из-за большей, в сравнении с бензоиновой конденсации, сложности, однако используется для синтеза несимметричных (с различными ароматическими заместителями) бензоинов:
- Ar-COCHO + Ar1H Ar-COCH(OH)-Ar1
Применение
Использование в органическом синтезе
Бензоин является исходным реагентом в синтезе бензила, используемого в качестве фотоинициатора[7] и бензиловой кислоты, использующейся в производстве лекарственных средств, таких как фенитоин и мепензолат.
Бензил синтезируют окислением бензоина с использованием различных окисляющих агентов (Cu (II), азотная кислота, хлор, йод и т.п.) в различных условиях; так, одним из лабораторных методов синтеза бензила в килограммовых масштабах является окисление бензоина в водном пиридине действием сульфата меди, выход составляет 86%[8]
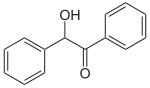 | → 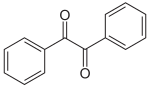 |
| Бензоин | Бензил |
Также показано (в миллимолярных масштабах), что бензоин (как и другие бензоины) может быть окислен в бензил кислородом воздуха при катализе оксидом алюминия в растворах метанола, акрилонитрила и дихлорметана[9].
Под действием оснований бензоин претерпевает бензоиновую перегруппировку, эта реакция используется как метод синтеза бензиловой кислоты[10]:
Восстановление бензоина амальгамой цинка (получаемой in situ из цинковой пыли и HgCl2) в смеси этанола и соляной кислоты используется как лабораторный метод синтеза транс-стильбена , выход составляет 53–57%[11]:
 | → 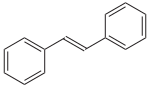 |
| Бензоин | транс-Стильбен |
Защита карбоксильной группы
Ацилирование бензоина карбоновыми кислотами с образованием сложных эфиров - дезилатов (Desyl Esters) используется как метод защиты карбоксильной группы. Синтез дезилатов может быть проведен различными методами, например, взаимодействием дезилбромида с карбоновой кислотой в присутствии диазабициклоундецена в бензоле, снятие защитной группы - действием ультрафиолета с λmax 350 нм в водном ацетонитриле (при этом дезильный остаток отщепляется с циклизацией в фенилбензо[b]фуран)[12] либо под действием видимого света в присутствии каталитических количеств 2,2-бипиридинового комплекса рутения (II) [Ru(bpy)3](PF6)2[13].
Примечания
- ↑ Benzoin. FischerSci. FischerSci. Дата обращения: 4 августа 2017. Архивировано 21 сентября 2015 года.
- ↑ Wöhler, Liebig; Wöhler, Liebig. Untersuchungen über das Radikal der Benzoesäure (нем.) // Annalen der Pharmacie[англ.] : magazin. — 1832. — Bd. 3, Nr. 3. — S. 249—282. — doi:10.1002/jlac.18320030302.
- ↑ N. Zinin; N. Zinin. Beiträge zur Kenntniss einiger Verbindungen aus der Benzoylreihe (нем.) // Annalen der Pharmacie[англ.] : magazin. — 1839. — Bd. 31, Nr. 3. — S. 329—332. — doi:10.1002/jlac.18390310312.
- ↑ N. Zinin; N. Zinin. Ueber einige Zersetzungsprodukte des Bittermandelöls (нем.) // Annalen der Pharmacie[англ.] : magazin. — 1840. — Bd. 34, Nr. 2. — S. 186—192. — doi:10.1002/jlac.18400340205.
- ↑ "BENZOIN". Organic Syntheses. 1: 33. 1921. doi:10.15227/orgsyn.001.0033. ISSN 2333-3553. Архивировано 3 августа 2023. Дата обращения: 28 февраля 2024.
- ↑ Arnold, Richard T.; Fuson, Reynold C. (1936-07-01). "A New Synthesis of Mixed Benzoins. Second Paper". Journal of the American Chemical Society. 58 (7): 1295—1296. doi:10.1021/ja01298a062. ISSN 0002-7863. Дата обращения: 28 февраля 2024.
- ↑ Hardo Siegel, Manfred Eggersdorfer «Ketones» in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, 2002 by Wiley-VCH, Wienheim. doi:10.1002/14356007.a15_077
- ↑ "BENZIL". Organic Syntheses. 6: 6. 1926. doi:10.15227/orgsyn.006.0006. ISSN 2333-3553. Архивировано 28 февраля 2024. Дата обращения: 28 февраля 2024.
- ↑ Konstantinos Skobridis. A very simple and chemoselective air oxidation of benzoins to benzils using alumina (англ.) // Arkivoc : journal. — 2006. — Vol. 06—1798JP. — P. 102—106. Архивировано 26 марта 2020 года.
- ↑ "BENZILIC ACID". Organic Syntheses. 1: 29. 1921. doi:10.15227/orgsyn.001.0029. ISSN 2333-3553. Архивировано 28 февраля 2024. Дата обращения: 28 февраля 2024.
- ↑ "trans-STILBENE". Organic Syntheses. 23: 86. 1943. doi:10.15227/orgsyn.023.0086. ISSN 2333-3553. Дата обращения: 7 марта 2024.
- ↑ Desyl Ester (pp. ) in Protection for the Carboxyl Group // Greene's Protective Groups in Organic Synthesis. — John Wiley & Sons, Ltd, 2014. — P. 686–836. — ISBN 978-1-118-90507-4.
- ↑ Speckmeier, Elisabeth; Zeitler, Kirsten (2017-10-06). "Desyl and Phenacyl as Versatile, Photocatalytically Cleavable Protecting Groups: A Classic Approach in a Different (Visible) Light". ACS Catalysis. 7 (10): 6821—6826. doi:10.1021/acscatal.7b02117. Дата обращения: 11 марта 2024.
Ссылки
- Benzoin synthesis, Organic Syntheses, Coll. Vol. 1, p. 94 (1941); Vol. 1, p. 33 (1921)