Вторичная структура — конформационное расположение главной цепи макромолекулы, независимо от конформации боковых цепей или отношения к другим сегментам. В описании вторичной структуры важным является определение водородных связей, которые стабилизируют отдельные фрагменты макромолекул.

Альфа-спираль (α-спираль) — типичный элемент вторичной структуры белков, который имеет форму правозакрученой винтовой линии и в котором каждая аминогруппа (-NH) в каркасе образует водородную связь с карбонильной группой (-C=O) аминокислоты, находящейся на 4 аминокислоты раньше. Этот элемент вторичной структуры иногда также называется классической альфа-спиралью Полинга — Кори — Брэнсона по именам авторов, впервые описавших эту структуру в 1951 году.

β-Лист — одна из форм регулярной вторичной структуры белков, немного более редкая, чем альфа-спираль. Бета-листы состоят из бета-цепей (нитей), связанных с боков двумя или тремя водородными связями, образуя слегка закрученные, складчатые листы.
Предсказа́ние структу́ры белка́ — направление молекулярного моделирования, предсказание по аминокислотной последовательности трёхмерной структуры белка. Данная задача является одной из самых важных целей биоинформатики и теоретической химии. Данные, полученные при помощи предсказания, применяются в медицине и биотехнологии при создании новых ферментов).

В биохимии карта Рамачандрана, первоначально разработанная в 1963 году Г.Н. Рамачандраном, К. Рамакришнаном и В. Сасисекхараном, представляет собой способ визуализирования энергетически разрешенных областей для двугранных углов ψ основной цепи в зависимости от φ аминокислотных остатков в структуре белка. Рисунок слева иллюстрирует определение основных двугранных углов φ и ψ. Угол ω при пептидной связи обычно составляет 180°, поскольку характер частичной двойной связи сохраняет пептидную связь плоской. На рисунке вверху справа показаны разрешенные конформационные области φ,ψ основной цепи из публикации Ramachandran et al. Расчеты твердых сфер 1963 и 1968 годов: полный радиус обозначен сплошным контуром, уменьшенный радиус — пунктиром, а ослабленный угол тау (N-Cα-C) — пунктирными линиями. Поскольку значения двугранного угла являются круглыми, а 0° соответствует 360°, края графика Рамачандрана «заворачиваются» справа налево и снизу вверх. Например, небольшая полоска разрешенных значений вдоль нижнего левого края графика является продолжением большой области расширенной цепочки в левом верхнем углу.

Шпи́лька — в молекулярной биологии элемент вторичной структуры РНК, а также одноцепочечной ДНК. Шпилька образуется в том случае, когда две последовательности одной и той же цепи комплементарны друг другу и соединяются друг с другом, перегибаясь одна к другой и образуя на конце неспаренный участок — петлю. Такие комплементарные последовательности нередко представляют собой палиндромные последовательности.

Ферредоксиновая укладка — это обычная укладка α+β с характерной вторичной структурой βαββαβ вдоль её основы. Структурно ферредоксиновую укладку можно описать как длинную симметричную шпильку, согнутую пополам так, что две концевые β-структуры образуют водородные связи с двумя центральными β-структурами, формируя четырёхнитевой антипараллельный бета-лист, покрытый с одной из сторон двумя концевыми α-спиралями.
Альфа-бунгаротоксин — белковый нейротоксин, который вырабатывается в ядовитых железах змеи Bungarus multicinctus. α-Бунгаротоксин специфически связывается с никотиновыми ацетилхолиновыми рецепторами (nAchR) на постсинаптических мембранах скелетных мышц, тем самым блокируя нейро-мышечную передачу. При более высокой дозе блокирует внеклеточное увеличение дофамина, вызванное действием никотина.

Карнитин-О-ацетилтрансфераза, также Карнитин-ацетилтрансфераза, сокр. КАТ (англ. Carnitine O-acetyltransferase, сокр. CRAT) — фермент (КФ 2.3.1.7), из семейства ацилтрансферазы (класс трансферазы), катализирующий перенос ацетильной группы (СH3-CO) от молекулы ацетил-КоА на молекулу субстрата — карнитина и обратно, когда субстратом уже служит кофермент А, по уравнению:

β-цилиндр - разновидность третичной структуры белков; β-складчатый слой, свернутый с образованием замкнутой структуры, в которой первая цепь водородными связями связана с последней. Как правило, β-цепи в β-цилиндрах расположены в антипараллельной ориентации. Чаще всего β-цилиндры формируют такие белки, как порины и другие пронизывающие мембраны белки, и белки, связывающие внутри цилиндра гидрофобные лиганды, такие как липокалины.
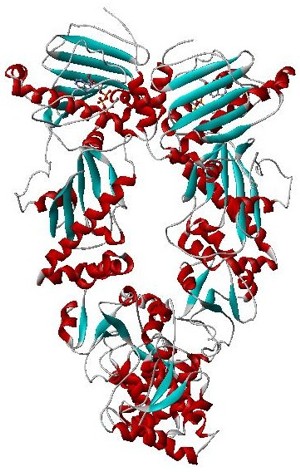
Hsp90, также белок теплового шока 90 — это белок-шаперон, который помогает другим белкам правильно складываться, стабилизирует белки от теплового стресса и способствует деградации белка. Он также стабилизирует ряд белков, необходимых для роста опухоли, поэтому ингибиторы Hsp90 исследуются как противораковые лекарственные средства.

B-Raf, или c-RAF — цитозольная серин/треониновая протеинкиназа семейства MAP3K. Продукт протоонкогена B-Raf BRAF.

Бета-спираль — это тандемная структура повтора белка, образованная объединением параллельных бета-цепей в спиральном узоре с двумя или тремя гранями. Бета-спираль — это тип соленоидного белкового домена. Структура стабилизируется межцепочечными водородными связями, белок-белковыми взаимодействиями, а иногда и связанными ионами металлов. Идентифицированы как левозакрученная, так и правозакрученная бета-спирали. Двухцепочечные бета-спирали также являются очень частой особенностью белков и обычно синонимичны укладке «Желейного рулета»

Бета-шпилька представляет собой простой структурный мотив белка, включающий две бета-нити, которые похожи на шпильку. Мотив состоит из двух смежных по первичной структуре нитей, ориентированных в антипараллельном направлении, связанных короткой петлей из двух-пяти аминокислот. Бета-шпильки могут встречаться изолированно или как часть ряда нитей, связанных водородными связями, которые вместе составляют бета-лист.

Тройная спираль коллагена или спираль типа 2 является основной вторичной структурой различных типов волокнистого коллагена, включая коллаген типа I. Он состоит из тройной спирали, состоящей из повторяющейся аминокислотной последовательности глицин -X-Y, где X и Y часто представляют собой пролин или гидроксипролин. Коллаген, свернутый в тройную спираль, известен как тропоколлаген. Тройные спирали коллагена часто связаны в фибриллы, которые сами образуют более крупные волокна, как в сухожилиях.

Спираль 310 (спираль 3.10) — тип вторичной структуры, встречающийся в белках и полипептидах. Из множества присутствующих вторичных структур белка 310-спираль является четвёртым наиболее часто наблюдаемым типом после α-спиралей, β-листов и β-поворотов. 310-спирали составляют почти 15-20 % от всех спиралей во вторичных структурах белков и обычно наблюдаются как продолжения α-спиралей, обнаруживаемые либо на их N-, либо на C-концах. 310-спирали в белках обычно имеют длину всего от трёх до пяти остатков по сравнению со средним значением 10-12 остатков для α-спиралей. Из-за тенденции α-спиралей к последовательному сворачиванию и разворачиванию было предложено, что 310-спираль служит своего рода промежуточной конформацией при сворачивании/разворачивании α-спиралей.

Пи-спираль — это тип вторичной структуры, обнаруженной в белках. Открытые кристаллографом Барбарой Лоу в 1952 году и когда-то считавшиеся редкостью, короткие π-спирали обнаруживаются в 15 % известных белковых структур и считаются эволюционной адаптацией, полученной путем вставки одной аминокислоты в α-спираль. Поскольку такие вставки сильно дестабилизируют белковую цепь, образование π-спиралей будет иметь тенденцию быть подверженными эволюционному отбору, если только это не обеспечит некоторые функциональные преимущества для белка. Следовательно, π-спирали обычно находятся рядом с функциональными сайтами белков.
Полипролиновая спираль — это тип вторичной структуры белка, который встречается в последовательностях аминокислот, содержащих повторяющиеся остатки пролина. Левозакрученная спираль полипролина II образуется, когда все последовательные аминокислотные остатки принимают двугранные углы основной цепи примерно и имеют транс- изомеры своих пептидных связей. Эта конформация PPII также характерна для белков и полипептидов с другими аминокислотами, кроме пролина. Аналогичным образом, более компактная правозакрученная спираль полипролина I образуется, когда все последовательные остатки принимают двугранные углы основной цепи примерно и имеют цис- изомеры своих пептидных связей. Из двадцати обычных встречающихся в природе аминокислот только пролин, вероятно, принимает цис- изомер пептидной связи, особенно пептидную связь X-Про; стерические и электронные факторы в значительной степени благоприятствуют транс- изомеру в большинстве других пептидных связей. Однако пептидные связи, которые заменяют пролин другой N- замещенной аминокислотой, также могут принимать цис- изомер.
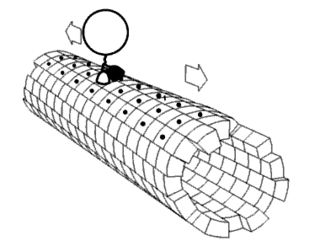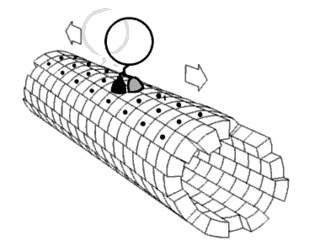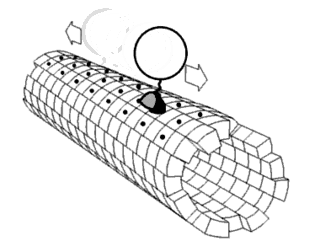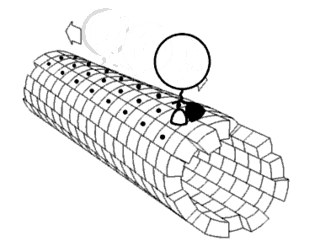
Считается, что белки имеют уникальные структуры, определяемые их аминокислотными последовательностями. Однако белки не являются строго статическими объектами, а скорее представляют ансамбли конформаций. Переходы между этими состояниями происходят в различных масштабах длины и временных масштабах и связаны с функционально значимыми явлениями, такими как аллостерическая передача сигналов и ферментативный катализ.
Стрептавидин представляет собой белок массой 66,0 (тетрамер) кДа, очищенный из бактерии Streptomyces avidinii. Гомотетрамеры стрептавидина обладают чрезвычайно высоким сродством к биотину (также известному как витамин B7 или витамин H). При константе диссоциации (Kd) порядка ≈10-14 моль/л связывание биотина со стрептавидином является одним из самых сильных нековалентных взаимодействий, известных в природе. Стрептавидин широко используется в молекулярной биологии и бионанотехнологии из-за устойчивости стрептавидин-биотинового комплекса к органическим растворителям, денатурантам (например, хлориду гуанидиния), детергентам (например, SDS, Triton X-100), протеолитические ферменты и экстремальные значения температуры и pH.