Бета-лист

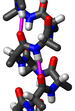
β-Лист (β-складчатый слой) — одна из форм регулярной вторичной структуры белков, немного более редкая, чем альфа-спираль. Бета-листы состоят из бета-цепей (нитей), связанных с боков двумя или тремя водородными связями, образуя слегка закрученные, складчатые листы.
Объединение множества бета-листов может приводить к образованию белковых агрегатов и фибрилл, наблюдаемых при многих заболеваниях человека и животных, в частности, амилоидозов (в том числе болезни Альцгеймера).
Номенклатура
Термины были заимствованы из английского языка: β-цепью (β-chain) или β-тяжем (β-strand) называют участок полипептидной цепи длиной от 3 до 10 аминокислот, в вытянутой, практически линейной форме; β-листом (β-sheet) называют структуру из как минимум двух β-цепочек, которые связаны между собой водородными связями.
История
Впервые структура β-листа была предложена Уильямом Астбери в 1930-х годах. Он высказал идею об образовании водородных связей между пептидными группами двух параллельных или антипараллельных β-цепей. Однако у Астбери не было достаточно данных по геометрии связей между аминокислотами для построения чёткой модели, особенно если учесть, что он не знал о планарности пептидной связи. Усовершенствованная модель была предложена Лайнусом Полингом и Робертом Кори в 1951 году[1]. Их модель включала планарность пептидной связи, которую они ранее объясняли как результат таутомеризации кето-енола.
Структура и ориентация


Геометрия
Основная часть β-тяжей расположена по соседству с другими тяжами и образует с ними обширную систему водородных связей между группами C=O и N-H пептидных остовов. В полностью вытянутом β-листе соседние β-тяжи идут вверх, затем вниз, затем опять вверх и т. д. Соседние β-тяжи в β-листе расположены таким образом, что их Cα-атомы находятся рядом и их боковые цепи указывают в одном направлении. Складчатая структура β-тяжа объясняется тем, что углы φ и ψ (между Cα и N-H и Cα и C=O, соответственно) меньше, чем 180° (−139° и +135°), что приводит к зигзагоподобной форме цепи. Расположение соседних тяжей может быть параллельным или антипараллельным, в зависимости от направления пептидных цепей. Антипараллельное расположение более предпочтительно, поскольку в этом случае межцепочечные водородные связи ориентированы параллельно друг другу и перпендикулярны оси симметрии β-листа.
Идеальный β-лист (такой, в котором конформация главной цепи всех аминокислотных остатков одинакова) имеет плоскую структуру. Однако в 1973 году Чотиа заметил, что в белках β-листы всегда скручены как правый пропеллер, а плоские и левопропеллерные β-листы практически не встречаются[2].
Аминокислотные особенности
Большие ароматические остатки (Тир, Фен, Трп) и β-разветвленные аминокислоты (Тре, Вал, Иле) чаще всего находятся в середине β-листа. Интересно, что такие аминокислотные остатки как Про располагаются по краям тяжей в β-листе, предположительно для избегания агрегации белков, которая может привести к формированию амилоидов[3].
Общие структурные мотивы

Мотив β-шпилька
Очень простым структурным мотивом, включающим β-листы, является β-шпилька, в которой две антипараллельные нити связаны короткой петлей из двух-пяти остатков, из которых один часто является глицином или пролином, оба из которых могут принимать конформации двугранного угла, необходимые для плотного поворота или петли β-выпуклости. Отдельные нити также могут быть связаны более сложными способами с более длинными петлями, которые могут содержать α-спирали.
Мотив "Греческий ключ"
Мотив греческого ключа состоит из четырех смежных антипараллельных нитей и соединяющих их петель. Он состоит из трех антипараллельных прядей, соединенных шпильками, в то время как четвертая примыкает к первой и связана с третьей более длинной петлей. Этот тип структуры легко образуется в процессе фолдинга белка[4]. Он был назван в честь узора, общего для греческого орнаментального искусства (см. Меандр).

β-α-β мотив

Из-за хиральности входящих в их состав аминокислот все нити демонстрируют правостороннее скручивание, очевидное в большинстве структур β-листа более высокого порядка. В частности, связующая петля между двумя параллельными нитями почти всегда имеет правую перекрестную хиральность, чему сильно способствует присущая листу извилистость.Эта связующая петля часто содержит спиральную область, и в этом случае она называется мотивом β-α-β. Близкородственный мотив, называемый мотивом β-α-β-α, образует основной компонент наиболее часто наблюдаемой третичной структуры белка - цилиндр ТИМА.
Мотив β-меандр

Простая белковая топология, состоящая из 2 или более последовательных антипараллельных β-нитей, соединенных вместе шпилечными петлями[5][6]. Этот мотив распространен в β-листах и может быть найден в нескольких структурных архитектурах, включая β-цилиндры и β-пропеллеры.
Мотив Ψ-петля
Мотив пси петли (Ψ-петли) состоит из двух антипараллельных нитей с одной нитью между ними, которая связана с обеими водородными связями. Существует четыре возможных топологии прядей для одиночных Ψ-петель. Этот мотив встречается редко, так как процесс, приводящий к его образованию, кажется маловероятным во время фолдинга белка. Ψ-петля была впервые идентифицирована в семействе аспарагиновых протеаз[7].
Структурные архитектуры белков с β-листами
β-листы присутствуют во всех-β, α+β и α/β доменах, а также во многих пептидах или небольших белках с плохо определенной общей архитектурой[8][9]. Все β-домены могут образовывать β-цилиндры, β-сэндвичи, β-призмы, β-пропеллеры и β-спирали.
Динамические функции
β-плиссированные листовые структуры состоят из протяженных β-нитевых полипептидных цепей, причем нити соединены со своими соседями водородными связями. Благодаря этой расширенной конформации позвоночника β-листы сопротивляются растяжению. β-листы в белках могут осуществлять низкочастотное, похожее на аккордеон, движение, наблюдаемое с помощью рамановской спектроскопии[10] и анализируемое с помощью квазинепрерывной модели[11].
Параллельные β-спирали

β-спираль образована из повторяющихся структурных единиц, состоящих из двух или трех коротких β-нитей, соединенных короткими петлями. Эти блоки "укладываются" друг на друга по спирали, так что последовательные повторения одной и той же нити образуют водородную связь друг с другом в параллельной ориентации. См. β-спираль
В левозакрученных β-спиралях сами нити довольно прямые и раскрученные; результирующие винтовые поверхности почти плоские, образующие правильную треугольную призматическую форму, как показано для 1QRE архейской углекислотной ангидразы справа. Другими примерами являются фермент синтеза липида А LpxA и белки антифриза насекомых с регулярным набором боковых цепей на одной грани, которые имитируют структуру льда[12].

Правосторонние β-спирали, типичные для фермента пектат-лиазы, показанного слева, или белка, похожего на хвост фага P22, имеют менее правильное поперечное сечение, более длинное и с отступом с одной из сторон; из трех петель линкера одна последовательно имеет длину всего два остатка, а другие являются переменными, часто разработанными для образования связующего или активного сайта[13].
Двусторонняя β-спираль (правозакрученная) обнаружена в некоторых бактериальных металлопротеазах; ее две петли имеют длину по шесть остатков каждая и связывают стабилизирующие ионы кальция для поддержания целостности структуры, используя основу и оксигены боковой цепи Asp мотива последовательности GGXGXD[14]. Эта складка называется β-рулоном в классификации SCOP.
См. Также
Примечания
- ↑ Pauling L., Corey RB. Configurations of Polypeptide Chains With Favored Orientations Around Single Bonds: Two New Pleated Sheets (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1951. — Vol. 37. — P. 729—740. — PMID 16578412. Архивировано 21 января 2021 года.
- ↑ Chothia C. Conformation of twisted beta-pleated sheets in proteins (англ.) // J Mol Biol.[англ.] : journal. — 1973. — Vol. 75. — P. 295—302. — PMID 4728692.
- ↑ J. S. Richardson, D. C. Richardson. Natural -sheet proteins use negative design to avoid edge-to-edge aggregation (англ.) // Proceedings of the National Academy of Sciences. — 2002-03-05. — Vol. 99, iss. 5. — P. 2754–2759. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.052706099.
- ↑ E.Gail Hutchinson, Janet M. Thornton. The Greek key motif: extraction, classification and analysis (англ.) // "Protein Engineering, Design and Selection". — 1993. — Vol. 6, iss. 3. — P. 233–245. — ISSN 1741-0134 1741-0126, 1741-0134. — doi:10.1093/protein/6.3.233.
- ↑ SCOP: Fold: WW domain-like. Архивировано из оригинала 4 февраля 2012 года.
- ↑ PPS '96 - Super Secondary Structure. Дата обращения: 4 августа 2021. Архивировано 28 декабря 2016 года.
- ↑ E. Gail Hutchinson, Janet M. Thornton. HERA—A program to draw schematic diagrams of protein secondary structures (англ.) // Proteins: Structure, Function, and Genetics. — 1990. — Vol. 8, iss. 3. — P. 203–212. — ISSN 1097-0134 0887-3585, 1097-0134. — doi:10.1002/prot.340080303. Архивировано 4 августа 2021 года.
- ↑ T. J. P. Hubbard, A. G. Murzin, S. E. Brenner, C. Chothia. SCOP: a Structural Classification of Proteins database (англ.) // Nucleic Acids Research. — 1997-01-01. — Vol. 25, iss. 1. — P. 236–239. — ISSN 1362-4962 0305-1048, 1362-4962. — doi:10.1093/nar/25.1.236. Архивировано 19 июля 2017 года.
- ↑ Naomi K. Fox, Steven E. Brenner, John-Marc Chandonia. SCOPe: Structural Classification of Proteins—extended, integrating SCOP and ASTRAL data and classification of new structures (англ.) // Nucleic Acids Research. — 2014-01. — Vol. 42, iss. D1. — P. D304–D309. — ISSN 1362-4962 0305-1048, 1362-4962. — doi:10.1093/nar/gkt1240. Архивировано 7 ноября 2021 года.
- ↑ P. C. Painter, L. E. Mosher, C. Rhoads. Low-frequency modes in the Raman spectra of proteins (англ.) // Biopolymers. — 1982-07. — Vol. 21, iss. 7. — P. 1469–1472. — ISSN 1097-0282 0006-3525, 1097-0282. — doi:10.1002/bip.360210715. Архивировано 4 августа 2021 года.
- ↑ K.C. Chou. Low-frequency motions in protein molecules. Beta-sheet and beta-barrel (англ.) // Biophysical Journal. — 1985-08. — Vol. 48, iss. 2. — P. 289–297. — doi:10.1016/S0006-3495(85)83782-6. Архивировано 10 февраля 2022 года.
- ↑ Yih-Cherng Liou, Ante Tocilj, Peter L. Davies, Zongchao Jia. Mimicry of ice structure by surface hydroxyls and water of a β-helix antifreeze protein (англ.) // Nature. — 2000-07. — Vol. 406, iss. 6793. — P. 322–324. — ISSN 1476-4687 0028-0836, 1476-4687. — doi:10.1038/35018604. Архивировано 4 августа 2021 года.
- ↑ Carl-Ivar Brändén. Introduction to protein structure. — 2nd ed. — New York: Garland Pub, 1999. — xiv, 410 pages с. — ISBN 0-8153-2304-2, 978-0-8153-2304-4, 0-8153-2305-0, 978-0-8153-2305-1. Архивировано 1 июня 2020 года.
- ↑ U. Baumann, S. Wu, K. M. Flaherty, D. B. McKay. Three-dimensional structure of the alkaline protease of Pseudomonas aeruginosa: a two-domain protein with a calcium binding parallel beta roll motif // The EMBO journal. — 1993-09. — Т. 12, вып. 9. — С. 3357–3364. — ISSN 0261-4189. Архивировано 4 августа 2021 года.
Дальнейшее чтение
- Super Secondary Structure - Part II. Principles of Protein Structure Using the Internet (31 мая 1996). Дата обращения: 25 мая 2007.
- Open-sided Beta-meander. Structural Classification of Proteins (SCOP) (20 октября 2006). Дата обращения: 31 мая 2007. Архивировано 4 февраля 2012 года.