Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс и другие комплексы.
Вторичная структура — конформационное расположение главной цепи макромолекулы, независимо от конформации боковых цепей или отношения к другим сегментам. В описании вторичной структуры важным является определение водородных связей, которые стабилизируют отдельные фрагменты макромолекул.

Альфа-спираль (α-спираль) — типичный элемент вторичной структуры белков, который имеет форму правозакрученой винтовой линии и в котором каждая аминогруппа (-NH) в каркасе образует водородную связь с карбонильной группой (-C=O) аминокислоты, находящейся на 4 аминокислоты раньше. Этот элемент вторичной структуры иногда также называется классической альфа-спиралью Полинга — Кори — Брэнсона по именам авторов, впервые описавших эту структуру в 1951 году.

Белки́ скользя́щего зажима, или скользя́щий зажи́м — белки, которые выполняют функцию усилителя процессивности при репликации ДНК.

Бактериородопси́ны — семейство мембранных светочувствительных белков археот. Бактериородопсины осуществляют перенос протона через плазматическую мембрану, по строению сходны с родопсинами млекопитающих.

β-Лист — одна из форм регулярной вторичной структуры белков, немного более редкая, чем альфа-спираль. Бета-листы состоят из бета-цепей (нитей), связанных с боков двумя или тремя водородными связями, образуя слегка закрученные, складчатые листы.
Предсказа́ние структу́ры белка́ — направление молекулярного моделирования, предсказание по аминокислотной последовательности трёхмерной структуры белка. Данная задача является одной из самых важных целей биоинформатики и теоретической химии. Данные, полученные при помощи предсказания, применяются в медицине и биотехнологии при создании новых ферментов).

Z-ДНК — одна из многих возможных структур двойной спирали ДНК, представляет собой левозакрученную двойную спираль. Z-ДНК является одной из трёх биологически активных двойных спиральных структур ДНК, наряду с А-ДНК и В-ДНК, хотя точные её функции к настоящему моменту не определены.

Спираль-поворот-спираль — мотив в белках, способный взаимодействовать с ДНК. Он состоит из двух α-спиралей, соединенных короткой цепью аминокислот и входит в состав многих белков, регулирующих экспрессию генов. Не следует путать с доменом типа «спираль-петля-спираль».
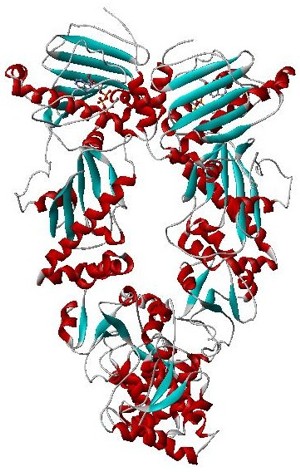
Hsp90, также белок теплового шока 90 — это белок-шаперон, который помогает другим белкам правильно складываться, стабилизирует белки от теплового стресса и способствует деградации белка. Он также стабилизирует ряд белков, необходимых для роста опухоли, поэтому ингибиторы Hsp90 исследуются как противораковые лекарственные средства.

Основная структура спираль-петля-спираль — это базовый структурный мотив, имеющийся у многих белков, принадлежащих к суперсемейству димеризующихся факторов транскрипции. Эти белки и называют bHLH белками. Не следует путать этот белковый структурный мотив с другим, похожим структурным мотивом белков, так называемым мотивом «спираль-поворот-спираль». Слово «базовый» относится не к сложности, а к химическому составу мотива, поскольку факторы транскрипции обычно содержат оснóвные аминокислотные остатки, чтобы облегчить связывание с ДНК.

mCherry — белок, входящий в группу мономерных красных флуоресцентных белков mFruits. Его природный белок-предшественник DsRed (RFP) был выделен из кораллов рода Discosoma отряда морских анемон. В отличие от DsRed mCherry является мономерным белком и его флуоресценция более стабильна, чем у его природного предшественника. Флуоресцентные белки применяются как клеточные метки для биологических исследований с помощью флуоресцентной микроскопии. mCherry поглощает свет в районе 540—590 нм и испускает свет в районе 550—650 нм. mCherry входит в семейство флуорецентных белковых флуорофоров, использующихся для экспериментальной визуализации генов и анализа их функций. Редактирование генома позволило с высокой точностью вводить эти флуоресцентные тэги в геном многих модельных организмов.

Бета-шпилька представляет собой простой структурный мотив белка, включающий две бета-нити, которые похожи на шпильку. Мотив состоит из двух смежных по первичной структуре нитей, ориентированных в антипараллельном направлении, связанных короткой петлей из двух-пяти аминокислот. Бета-шпильки могут встречаться изолированно или как часть ряда нитей, связанных водородными связями, которые вместе составляют бета-лист.

Тройная спираль коллагена или спираль типа 2 является основной вторичной структурой различных типов волокнистого коллагена, включая коллаген типа I. Он состоит из тройной спирали, состоящей из повторяющейся аминокислотной последовательности глицин -X-Y, где X и Y часто представляют собой пролин или гидроксипролин. Коллаген, свернутый в тройную спираль, известен как тропоколлаген. Тройные спирали коллагена часто связаны в фибриллы, которые сами образуют более крупные волокна, как в сухожилиях.
Бета-выпуклость может быть описана как локализованное нарушение регулярной водородной связи бета-листа путем вставки дополнительных аминокислотных остатков в одну или обе водородные связи β-цепей.

Спираль 310 (спираль 3.10) — тип вторичной структуры, встречающийся в белках и полипептидах. Из множества присутствующих вторичных структур белка 310-спираль является четвёртым наиболее часто наблюдаемым типом после α-спиралей, β-листов и β-поворотов. 310-спирали составляют почти 15-20 % от всех спиралей во вторичных структурах белков и обычно наблюдаются как продолжения α-спиралей, обнаруживаемые либо на их N-, либо на C-концах. 310-спирали в белках обычно имеют длину всего от трёх до пяти остатков по сравнению со средним значением 10-12 остатков для α-спиралей. Из-за тенденции α-спиралей к последовательному сворачиванию и разворачиванию было предложено, что 310-спираль служит своего рода промежуточной конформацией при сворачивании/разворачивании α-спиралей.

Пи-спираль — это тип вторичной структуры, обнаруженной в белках. Открытые кристаллографом Барбарой Лоу в 1952 году и когда-то считавшиеся редкостью, короткие π-спирали обнаруживаются в 15 % известных белковых структур и считаются эволюционной адаптацией, полученной путем вставки одной аминокислоты в α-спираль. Поскольку такие вставки сильно дестабилизируют белковую цепь, образование π-спиралей будет иметь тенденцию быть подверженными эволюционному отбору, если только это не обеспечит некоторые функциональные преимущества для белка. Следовательно, π-спирали обычно находятся рядом с функциональными сайтами белков.
Полипролиновая спираль — это тип вторичной структуры белка, который встречается в последовательностях аминокислот, содержащих повторяющиеся остатки пролина. Левозакрученная спираль полипролина II образуется, когда все последовательные аминокислотные остатки принимают двугранные углы основной цепи примерно и имеют транс- изомеры своих пептидных связей. Эта конформация PPII также характерна для белков и полипептидов с другими аминокислотами, кроме пролина. Аналогичным образом, более компактная правозакрученная спираль полипролина I образуется, когда все последовательные остатки принимают двугранные углы основной цепи примерно и имеют цис- изомеры своих пептидных связей. Из двадцати обычных встречающихся в природе аминокислот только пролин, вероятно, принимает цис- изомер пептидной связи, особенно пептидную связь X-Про; стерические и электронные факторы в значительной степени благоприятствуют транс- изомеру в большинстве других пептидных связей. Однако пептидные связи, которые заменяют пролин другой N- замещенной аминокислотой, также могут принимать цис- изомер.
Спиральная катушка — структурный мотив в белках, в котором 2-7 альфа-спиралей свернуты вместе, как нити веревки. Многие белки типа спиральной катушки участвуют в важных биологических функциях, таких как регуляция экспрессии генов — например, факторы транскрипции. Яркими примерами являются онкопротеины c-Fos и c-jun, а также мышечный белок тропомиозин.
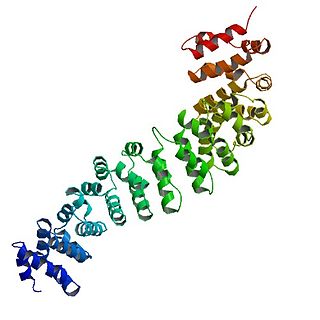
Бета-катенин, или β-катенин — это белок, участвующий в клеточной адгезии и в регуляции экспрессии генов. В клеточной адгезии бета-катенин выполняет свои функции, соединяя цитоплазматическую часть кадгерина с α-катенином и F-актином. При регуляции экспрессии генов бета-катенин выступает в качестве внутриклеточного передатчика сигнала в сигнальном пути Wnt, играющего важную роль в эмбриональном развитии и гомеостазе тканей. Бета-катенин входит в семейство белков катенинов и гомологичен γ-катенину, также известному как плакоглобин. Бета-катенин у человека кодируется геном CTNNB1, у дрозофилы гомологичный белок называется armadillo. Бета-катенин широко экспрессируется во многих тканях.