
Фибронектин — гликопротеин внеклеточного матрикса, который связывается с мембранными рецепторными белками, называемыми интегринами. Фибронектин также связывается с другими белками внеклеточного матрикса, такими как коллаген, фибрин, гепарансульфат-протеогликаны.

Альфа-спираль (α-спираль) — типичный элемент вторичной структуры белков, который имеет форму правозакрученой винтовой линии и в котором каждая аминогруппа (-NH) в каркасе образует водородную связь с карбонильной группой (-C=O) аминокислоты, находящейся на 4 аминокислоты раньше. Этот элемент вторичной структуры иногда также называется классической альфа-спиралью Полинга — Кори — Брэнсона по именам авторов, впервые описавших эту структуру в 1951 году.
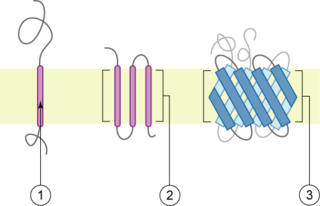
Трансмембранный белок — мембранный белок, который насквозь пронизывает липидный бислой, в котором он постоянно находится. Трансмембранные белки плотно закрепляются в мембране при помощи специального класса липидов, называемых кольцевая липидная оболочка. Многие из этих белков выполняют транспортную функцию, позволяя специфическим веществам пересекать биологическую мембрану, чтобы попасть внутрь клетки или же напротив, не давая им покинуть её пределов.

β-Лист — одна из форм регулярной вторичной структуры белков, немного более редкая, чем альфа-спираль. Бета-листы состоят из бета-цепей (нитей), связанных с боков двумя или тремя водородными связями, образуя слегка закрученные, складчатые листы.
Предсказа́ние структу́ры белка́ — направление молекулярного моделирования, предсказание по аминокислотной последовательности трёхмерной структуры белка. Данная задача является одной из самых важных целей биоинформатики и теоретической химии. Данные, полученные при помощи предсказания, применяются в медицине и биотехнологии при создании новых ферментов).

Интегрин альфа-V — мембранный белок, гликопротеин из надсемейства интегринов, продукт гена ITGAV.
PTEN — фосфатаза с двойной субстратной специфичностью, продукт гена PTEN. Субстратами этой фосфатазы могут быть как белки, так и фосфатидилинозитол-3-фосфаты. PTEN катализирует отщепление фосфатной группы в положении 3D инозитольного кольца фосфатидилинозитол-3-фосфатов, лишая их таким образом функций вторичных посредников при передаче сигнала в клетке. Эта фосфатаза является одним из немногих негативных регуляторов PI3K/AKT/mTOR-сигнального пути, что делает её антионкобелком. Ген PTEN часто бывает мутирован при различных типах злокачественных опухолей.

Укладка Россманна — структурный мотив в третичной структуре белка, который связывает нуклеотиды. Структура, состоящая из двух идентичных частей, содержит шесть почти параллельных β-листов, соединённых между собой двумя парами α-спиралей, следующих в порядке β-α-β-α-β. Поскольку каждая укладка Россманна может связать один нуклеотид, связывающий домен для динуклеотидов, таких как НАД, состоит из двух параллельных укладок Россманна. Одиночная укладка Россманна может связать мононуклеотид, например, кофактор ФМН.

Цитохром f — самая большая субъединица цитохром-b6/f комплекса шифр КФ 1.10.99.1. По своей структуре и функциям цитохром-b6/f комплекс аналогичен цитохром-b/c1 комплексу митохондрий и пурпурных бактерий. Цитохром f играет роль аналогичную цитохрому c1, несмотря на их различия по вторичной структуре.

Vault, или цитоплазмати́ческий рибонуклеопротеи́н vault, — эукариотическая органелла, химически представляет собой рибонуклеопротеин. Под электронным микроскопом эти органеллы напоминают свод купола собора с осью симметрии 39-го порядка. Функции vault плохо изучены, однако к настоящему времени имеются свидетельства об участии их в различных сигнальных путях клетки. Возможно, vault вовлечены в развитие явления множественной лекарственной устойчивости к противораковой химиотерапии. Они имеются во многих типах эукариотических клеток и высококонсервативны среди эукариот.

Электронпереносящий флавопротеин или ETF — флавопротеин, расположенный во внутренней митохондриальной мембране со стороны матрикса. Это специфический переносчик электронов, который получает их от различных дегидрогеназ. Он окисляется ETF-дегидрогеназой, которая передаёт электроны в дыхательную цепь переноса электронов. Электронпереносящий флавопротеины подразделяют на две группы в соответствии с их функциями: конститутивные или ETF «домашнего хозяйства», которые участвуют в окислении жирных кислот, и ETF, синтезируемые некоторыми прокариотами в определённых условиях для получения электронов от окисления определённых субстратов.

Спираль-поворот-спираль — мотив в белках, способный взаимодействовать с ДНК. Он состоит из двух α-спиралей, соединенных короткой цепью аминокислот и входит в состав многих белков, регулирующих экспрессию генов. Не следует путать с доменом типа «спираль-петля-спираль».

β-цилиндр - разновидность третичной структуры белков; β-складчатый слой, свернутый с образованием замкнутой структуры, в которой первая цепь водородными связями связана с последней. Как правило, β-цепи в β-цилиндрах расположены в антипараллельной ориентации. Чаще всего β-цилиндры формируют такие белки, как порины и другие пронизывающие мембраны белки, и белки, связывающие внутри цилиндра гидрофобные лиганды, такие как липокалины.

Бета-спираль — это тандемная структура повтора белка, образованная объединением параллельных бета-цепей в спиральном узоре с двумя или тремя гранями. Бета-спираль — это тип соленоидного белкового домена. Структура стабилизируется межцепочечными водородными связями, белок-белковыми взаимодействиями, а иногда и связанными ионами металлов. Идентифицированы как левозакрученная, так и правозакрученная бета-спирали. Двухцепочечные бета-спирали также являются очень частой особенностью белков и обычно синонимичны укладке «Желейного рулета»

Бета-шпилька представляет собой простой структурный мотив белка, включающий две бета-нити, которые похожи на шпильку. Мотив состоит из двух смежных по первичной структуре нитей, ориентированных в антипараллельном направлении, связанных короткой петлей из двух-пяти аминокислот. Бета-шпильки могут встречаться изолированно или как часть ряда нитей, связанных водородными связями, которые вместе составляют бета-лист.
Бета-выпуклость может быть описана как локализованное нарушение регулярной водородной связи бета-листа путем вставки дополнительных аминокислотных остатков в одну или обе водородные связи β-цепей.

Спираль 310 (спираль 3.10) — тип вторичной структуры, встречающийся в белках и полипептидах. Из множества присутствующих вторичных структур белка 310-спираль является четвёртым наиболее часто наблюдаемым типом после α-спиралей, β-листов и β-поворотов. 310-спирали составляют почти 15-20 % от всех спиралей во вторичных структурах белков и обычно наблюдаются как продолжения α-спиралей, обнаруживаемые либо на их N-, либо на C-концах. 310-спирали в белках обычно имеют длину всего от трёх до пяти остатков по сравнению со средним значением 10-12 остатков для α-спиралей. Из-за тенденции α-спиралей к последовательному сворачиванию и разворачиванию было предложено, что 310-спираль служит своего рода промежуточной конформацией при сворачивании/разворачивании α-спиралей.
Полипролиновая спираль — это тип вторичной структуры белка, который встречается в последовательностях аминокислот, содержащих повторяющиеся остатки пролина. Левозакрученная спираль полипролина II образуется, когда все последовательные аминокислотные остатки принимают двугранные углы основной цепи примерно и имеют транс- изомеры своих пептидных связей. Эта конформация PPII также характерна для белков и полипептидов с другими аминокислотами, кроме пролина. Аналогичным образом, более компактная правозакрученная спираль полипролина I образуется, когда все последовательные остатки принимают двугранные углы основной цепи примерно и имеют цис- изомеры своих пептидных связей. Из двадцати обычных встречающихся в природе аминокислот только пролин, вероятно, принимает цис- изомер пептидной связи, особенно пептидную связь X-Про; стерические и электронные факторы в значительной степени благоприятствуют транс- изомеру в большинстве других пептидных связей. Однако пептидные связи, которые заменяют пролин другой N- замещенной аминокислотой, также могут принимать цис- изомер.

Желейный рулет или швейцарский рулет — белковая укладка или сверхвторичная структура, состоящая из восьми бета-нитей, расположенных в двух четырёхнитевых листах. Название структуры, введённое Джейн С. Ричардсон в 1981 году, отражает его сходство с желейным или швейцарским пирогом. Укладка является продолжением мотива «Греческий ключ» и иногда считается формой бета-цилиндра. Она очень часто встречается в вирусных белках, особенно в вирусных капсидных белках. Взятые вместе, желейный рулет и греческий ключ составляют около 30 % всех бета-белков, аннотированных в базе данных структурной классификации белков (SCOP).
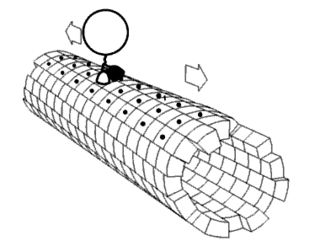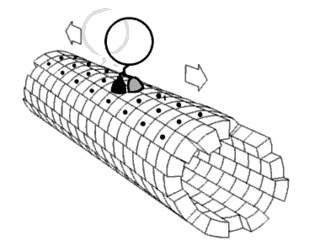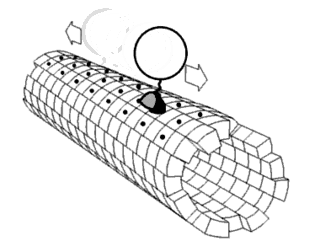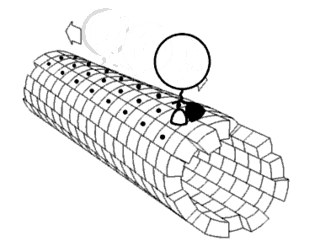
Считается, что белки имеют уникальные структуры, определяемые их аминокислотными последовательностями. Однако белки не являются строго статическими объектами, а скорее представляют ансамбли конформаций. Переходы между этими состояниями происходят в различных масштабах длины и временных масштабах и связаны с функционально значимыми явлениями, такими как аллостерическая передача сигналов и ферментативный катализ.
















