
Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс и другие комплексы.

Липокалины — это группа транспортных белков с характерной вторичной структурой. Они содержат восемь антипараллельных пептидных последовательностей на основе бета-складчатой структуры, которые формируют цилиндр. Такой «цилиндр» содержит внутри лиганд-связывающий участок.

Предшественник бета-амилоида — трансмембранный белок, экспрессируемый во многих тканях и концентрирующийся в синапсах нейронов.Его основная функция неизвестна, Хотя он был вовлечен в качестве регулятора образования синапсов, нейропластичности, антимикробной активности и транспорта железа. Наиболее известный тем, что его фрагмент, бета-амилоид, является основным составляющим амилоидных бляшек при болезни Альцгеймера.

β-Лист — одна из форм регулярной вторичной структуры белков, немного более редкая, чем альфа-спираль. Бета-листы состоят из бета-цепей (нитей), связанных с боков двумя или тремя водородными связями, образуя слегка закрученные, складчатые листы.
Предсказа́ние структу́ры белка́ — направление молекулярного моделирования, предсказание по аминокислотной последовательности трёхмерной структуры белка. Данная задача является одной из самых важных целей биоинформатики и теоретической химии. Данные, полученные при помощи предсказания, применяются в медицине и биотехнологии при создании новых ферментов).

В биохимии карта Рамачандрана, первоначально разработанная в 1963 году Г.Н. Рамачандраном, К. Рамакришнаном и В. Сасисекхараном, представляет собой способ визуализирования энергетически разрешенных областей для двугранных углов ψ основной цепи в зависимости от φ аминокислотных остатков в структуре белка. Рисунок слева иллюстрирует определение основных двугранных углов φ и ψ. Угол ω при пептидной связи обычно составляет 180°, поскольку характер частичной двойной связи сохраняет пептидную связь плоской. На рисунке вверху справа показаны разрешенные конформационные области φ,ψ основной цепи из публикации Ramachandran et al. Расчеты твердых сфер 1963 и 1968 годов: полный радиус обозначен сплошным контуром, уменьшенный радиус — пунктиром, а ослабленный угол тау (N-Cα-C) — пунктирными линиями. Поскольку значения двугранного угла являются круглыми, а 0° соответствует 360°, края графика Рамачандрана «заворачиваются» справа налево и снизу вверх. Например, небольшая полоска разрешенных значений вдоль нижнего левого края графика является продолжением большой области расширенной цепочки в левом верхнем углу.

Бета-амило́иды — общее название для нескольких пептидов, состоящих из примерно 40 аминокислотных остатков и образующихся из трансмембранного белка — предшественника бета-амилоида. Основными разновидностями являются пептид из 40 аминокислотных остатков (Aβ40) и пептид из 42 аминокислотных остатков (Aβ42). Их роль в нормальной физиологии остаётся неизвестной, но предполагается, что они могут участвовать в антибактериальной и противогрибковой защите. Пептид Aβ40 не имеет патогенных свойств, но пептид Aβ42 считается одним из основных факторов, провоцирующих болезнь Альцгеймера и часто называется просто бета-амилоидом, без уточнения длины аминокислотной цепочки. В мозге пациента, страдающего болезнью Альцгеймера, этот пептид может образовывать так называемые амилоидные бляшки, состоящие из скоплений пептида, свёрнутого в виде бета-складки. Пептид Aβ42 может также образовывать олигомеры, которые запускают цепные реакции образования амилоидных бляшек и тау-белков по прионному механизму.

mCherry — белок, входящий в группу мономерных красных флуоресцентных белков mFruits. Его природный белок-предшественник DsRed (RFP) был выделен из кораллов рода Discosoma отряда морских анемон. В отличие от DsRed mCherry является мономерным белком и его флуоресценция более стабильна, чем у его природного предшественника. Флуоресцентные белки применяются как клеточные метки для биологических исследований с помощью флуоресцентной микроскопии. mCherry поглощает свет в районе 540—590 нм и испускает свет в районе 550—650 нм. mCherry входит в семейство флуорецентных белковых флуорофоров, использующихся для экспериментальной визуализации генов и анализа их функций. Редактирование генома позволило с высокой точностью вводить эти флуоресцентные тэги в геном многих модельных организмов.

FABP1 — внутриклеточный белок из семейства белков, связывающий жирные кислоты (FABP). Продукт гена человека FABP1. FABP1 в основном экспрессирован в печени, где белок участвует в связывании, транспорте и метаболизме длинноцепочечных жирных кислот, эндоканнабиноидов и фитоканнабиноидов и других гидрофобных молекул. Нарушенние в экспрессии белка коррелирует с метаболическими заболевания, включая ожирение.

β-сэндвич домены состоят из 80-350 аминокислот и обычно встречаются в белках. Они характеризуются двумя противопоставленными антипараллельными β-листами. Количество нитей, обнаруживаемых в таких доменах, может отличаться от одного белка к другому. β-сэндвич-домены встречаются во множестве типов различных укладок.

Бета-спираль — это тандемная структура повтора белка, образованная объединением параллельных бета-цепей в спиральном узоре с двумя или тремя гранями. Бета-спираль — это тип соленоидного белкового домена. Структура стабилизируется межцепочечными водородными связями, белок-белковыми взаимодействиями, а иногда и связанными ионами металлов. Идентифицированы как левозакрученная, так и правозакрученная бета-спирали. Двухцепочечные бета-спирали также являются очень частой особенностью белков и обычно синонимичны укладке «Желейного рулета»

Бета-шпилька представляет собой простой структурный мотив белка, включающий две бета-нити, которые похожи на шпильку. Мотив состоит из двух смежных по первичной структуре нитей, ориентированных в антипараллельном направлении, связанных короткой петлей из двух-пяти аминокислот. Бета-шпильки могут встречаться изолированно или как часть ряда нитей, связанных водородными связями, которые вместе составляют бета-лист.
Бета-выпуклость может быть описана как локализованное нарушение регулярной водородной связи бета-листа путем вставки дополнительных аминокислотных остатков в одну или обе водородные связи β-цепей.

Спираль 310 (спираль 3.10) — тип вторичной структуры, встречающийся в белках и полипептидах. Из множества присутствующих вторичных структур белка 310-спираль является четвёртым наиболее часто наблюдаемым типом после α-спиралей, β-листов и β-поворотов. 310-спирали составляют почти 15-20 % от всех спиралей во вторичных структурах белков и обычно наблюдаются как продолжения α-спиралей, обнаруживаемые либо на их N-, либо на C-концах. 310-спирали в белках обычно имеют длину всего от трёх до пяти остатков по сравнению со средним значением 10-12 остатков для α-спиралей. Из-за тенденции α-спиралей к последовательному сворачиванию и разворачиванию было предложено, что 310-спираль служит своего рода промежуточной конформацией при сворачивании/разворачивании α-спиралей.

Пи-спираль — это тип вторичной структуры, обнаруженной в белках. Открытые кристаллографом Барбарой Лоу в 1952 году и когда-то считавшиеся редкостью, короткие π-спирали обнаруживаются в 15 % известных белковых структур и считаются эволюционной адаптацией, полученной путем вставки одной аминокислоты в α-спираль. Поскольку такие вставки сильно дестабилизируют белковую цепь, образование π-спиралей будет иметь тенденцию быть подверженными эволюционному отбору, если только это не обеспечит некоторые функциональные преимущества для белка. Следовательно, π-спирали обычно находятся рядом с функциональными сайтами белков.
Полипролиновая спираль — это тип вторичной структуры белка, который встречается в последовательностях аминокислот, содержащих повторяющиеся остатки пролина. Левозакрученная спираль полипролина II образуется, когда все последовательные аминокислотные остатки принимают двугранные углы основной цепи примерно и имеют транс- изомеры своих пептидных связей. Эта конформация PPII также характерна для белков и полипептидов с другими аминокислотами, кроме пролина. Аналогичным образом, более компактная правозакрученная спираль полипролина I образуется, когда все последовательные остатки принимают двугранные углы основной цепи примерно и имеют цис- изомеры своих пептидных связей. Из двадцати обычных встречающихся в природе аминокислот только пролин, вероятно, принимает цис- изомер пептидной связи, особенно пептидную связь X-Про; стерические и электронные факторы в значительной степени благоприятствуют транс- изомеру в большинстве других пептидных связей. Однако пептидные связи, которые заменяют пролин другой N- замещенной аминокислотой, также могут принимать цис- изомер.

Желейный рулет или швейцарский рулет — белковая укладка или сверхвторичная структура, состоящая из восьми бета-нитей, расположенных в двух четырёхнитевых листах. Название структуры, введённое Джейн С. Ричардсон в 1981 году, отражает его сходство с желейным или швейцарским пирогом. Укладка является продолжением мотива «Греческий ключ» и иногда считается формой бета-цилиндра. Она очень часто встречается в вирусных белках, особенно в вирусных капсидных белках. Взятые вместе, желейный рулет и греческий ключ составляют около 30 % всех бета-белков, аннотированных в базе данных структурной классификации белков (SCOP).
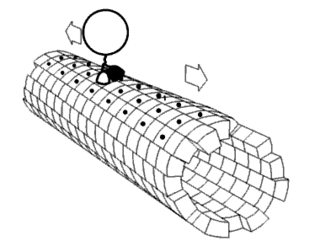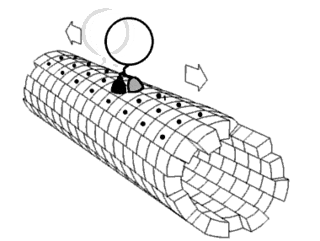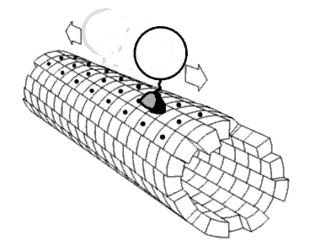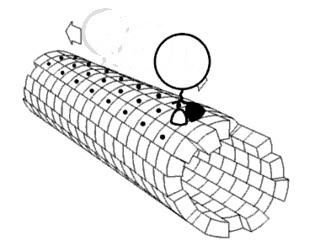
Считается, что белки имеют уникальные структуры, определяемые их аминокислотными последовательностями. Однако белки не являются строго статическими объектами, а скорее представляют ансамбли конформаций. Переходы между этими состояниями происходят в различных масштабах длины и временных масштабах и связаны с функционально значимыми явлениями, такими как аллостерическая передача сигналов и ферментативный катализ.

Перифери́ческие мембра́нные белки́, или внéшние мембрáнные белки́, представляют собой мембранные белки, которые обычно непрочно и лишь временно прикрепляются к биологической мембране, с которой они связаны. Данные белки прикрепляются к интегральным мембранным белкам или проникают в периферические области липидного бислоя. Например, регуляторные белковые субъединицы многих ионных каналов и трансмембранных рецепторов можно определить как периферические мембранные белки. В отличие от интегральных мембранных белков, периферические мембранные белки обычно собираются в водорастворимый компонент, или фракцию, всех белков, выделенных в ходе процедуры очистки белков. Белки с GPI-якорями являются исключением из этого правила и могут иметь свойства очистки, аналогичные свойствам интегральных мембранных белков.

















