Ами́ды — производные кислородсодержащих кислот, в которых гидроксильная группа кислотного остатка заменена аминогруппой. Амиды также можно рассматривать как ацилпроизводные аминов. Соединения с одним, двумя или тремя ацильными заместителями у атома азота называются первичными, вторичными и третичными амидами соответственно. Вторичные амиды также называют имидами.
Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы. По числу замещённых атомов водорода различают соответственно первичные (замещён один атом водорода), вторичные (замещены два атома из трёх) и третичные амины (замещены все три атома). Выделяют также четвертичные аммониевые соединения вида R4N+X-.

Органи́ческая хи́мия — раздел химии, изучающий структуру, свойства и методы синтеза соединений углерода с другими химическими элементами, относящихся к органическим соединениям. Первоначальное значение термина органическая химия подразумевало изучение только соединений углерода растительного и животного происхождения. По этой причине ряд углеродсодержащих соединений традиционно не относят к органическим, а рассматривают как неорганические соединения. Условно можно считать, что структурным прототипом органических соединений являются углеводороды.

Алке́ны — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.

Органи́ческие соедине́ния, органические вещества́ — класс химических веществ, объединяющий почти все химические соединения, в состав которых входят атомы углерода, связанные с атомами других химических элементов. Изучаются в органической химии, и на начальном этапе её развития к органическим относили только соединения углерода растительного и животного происхождения. В силу этих исторических причин ряд углеродсодержащих соединений традиционно не относят к органическим, а рассматривают как неорганические соединения — например, монооксид углерода, диоксид углерода, циановодород, сероуглерод, карбонилы металлов, карбонаты, цианиды, роданиды. Условно можно считать, что структурным прототипом органических соединений являются углеводороды. Органические соединения, наряду с углеродом (C), чаще всего содержат водород (H), кислород (O), азот (N), значительно реже — серу (S), фосфор (P), галогены, бор (B) и некоторые металлы.

Альдеги́ды — класс органических соединений, содержащих альдегидную группу (-CHO). ИЮПАК определяет альдегиды как вещества вида R-CHO, в которых карбонильная группа связана с одним атомом водорода и одной группой R.

Алки́ны — ациклические непредельные углеводороды, содержащие одну тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.

Хими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или более элементов. Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью . Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
В органической химии существует огромное число реакций, носящих имя исследователя, открывшего или исследовавшего данную реакцию. Часто в названии реакции фигурируют имена нескольких учёных: это могут быть авторы первой публикации, первооткрыватель и исследователь реакции, учёные, одновременно опубликовавшие результаты о новой реакции.
Алифатические соединения в органической химии — соединения, не содержащие ароматических связей. Алифатические соединения могут представлять собой открытые цепи или замкнутые. Иногда к алифатическим соединениям относят только ациклические, а алициклические выделяют в отдельный класс.
Азотсодержащие органические соединения — весьма обширный класс органических соединений, в состав которых входит азот.
Нитроны (азометиноксиды) — N-оксиды иминов общей формулы R1R2C=N+(O−)R3 (R3 ≠ H). В зависимости от степени замещения при атоме углерода различают альдонитроны (R1 = Н, R2 — органический радикал) и кетонитроны (R1, R2 ≠ H). Изомерны с изонитронами (оксазиридинами).

Изоциа́новая кислота́ — бесцветная жидкость с резким запахом, схожим с запахом уксусной кислоты, является стабильной таутомерной формой циановой кислоты HOCN. В высоких концентрациях — токсична. Соли циановой кислоты впервые описаны Вёлером в 1824 г., сама циановая кислота получена Либихом и Вёлером в 1830 г.. Является изомером фульминовой (парациановой) кислоты (H-C≡N→O). Образует соли — изоцианаты.
Азиды — органические соединения, содержащие азидную группу -N=N+=N−, обычно связанную с атомом углерода, однако к азидам также относят и элементоорганические соединения (например, триалкилсилил- и триалкилстаннилазиды), и азидпроизводные сульфокислот (сульфонилазиды RSO2N3).
Ониевые соединения - катионы общей формулы Rn+1En+, где E - атом элемента Va-VIIa подгрупп, а n - низшая степень окисления элемента и их соли
Пра́вило Марко́вникова — в органической химии правило, используемое для предсказания региоселективности реакции присоединения протонных кислот и воды к несимметричным алкенам и алкинам. Наиболее часто данное правило формулируют следующим образом: при присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Впервые правило было предложено русским химиком В. В. Марковниковым в 1869 году.

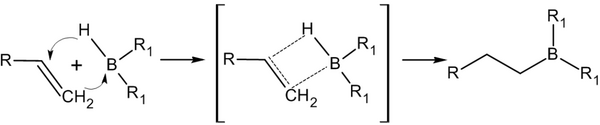
Дисиамилборан — бороорганическое соединение с формулой B(C5H11)2H. Дисиамилборан обладает способностью гидроборировать алкены и алкины, на чём и основано его применение в органическом синтезе.
Алифатические амины — разновидность органических соединений, принадлежащих к классу аминов, которая отличается содержанием алифатических заместителей у атома азота. Впервые простейшие алифатические амины синтезировал Шарль Вюрц в 1849 году. Для их получения он гидролизовал соответствующие алкилизоцианаты, триалкилцианураты и алкилмочевины. Фундаментальное же изучение свойств, структуры и методов синтеза алифатических аминов провёл Август Вильгельм Гофман. Он же предложил термины "первичный", "вторичный", "третичный" для обозначения их структуры.

Гидрид диизобутилалюминия — алюминийорганическое соединение, используемое в органическом синтезе в качестве восстановителя соединений различных классов. Представляет собой бесцветную жидкость, обладающую пирофорными свойствами.

Катехолборан — борорганическое соединение, производное борана и пирокатехина, применяемое в органическом синтезе как восстановитель, реагент для синтеза замещённых борных кислот, а также.