Бромид висмута(III)
| Бромид висмута(III) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Бромид висмута(III) |
| Традиционные названия | Бромистый висмут |
| Хим. формула | BiBr3 |
| Физические свойства | |
| Состояние | жёлтые кристаллы |
| Молярная масса | 448,71 г/моль |
| Плотность | 5,65; 5,72 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 200; 218; 219 °C |
| • кипения | 453; 460; 461 °C |
| Мол. теплоёмк. | 108,6 Дж/(моль·К) |
| Энтальпия | |
| • образования | −276 кДж/моль |
| Классификация | |
| Рег. номер CAS | 7787-58-8 |
| PubChem | 24884077 |
| Рег. номер EINECS | 232-121-1 |
| SMILES | |
| InChI | |
| ChemSpider | 74210 |
| Безопасность | |
| Токсичность | токсичен, обладает коррозионной активностью |
| Пиктограммы ECB | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Бромид висмута(III) — бинарное неорганическое соединение, соль металла висмута и бромистоводородной кислоты с формулой BiBr3, лимонно-жёлтые кристаллы.
Получение
- Непосредственное взаимодействие элементов:
- Действие брома на оксид висмута(III) или сульфид висмута(III):
Физические свойства
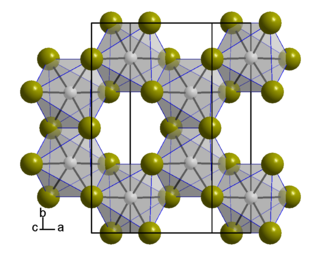
Бромид висмута(III) образует лимонно-жёлтые гигроскопичные кристаллы моноклинной сингонии.
Ядовит, обладает сильным токсическим и коррозионным действием.
Легко очищается возгонкой.
Растворяется в этаноле, ацетоне, ксилоле, диэтиловом эфире и жидком аммиаке.
Образует аддукты вида BiBr3•2NH3, BiBr3•3NH3 и BiBr3•2HBr•4H2O.
Химические свойства
- Разлагается водой с образованием оксида-бромида висмута:
- Реагирует с сероводородом:
- Восстанавливается водородом до металла:
- С бромидами металлов образует растворимые комплексы:
Применение
- Катализатор в органическом синтезе.
См. также
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.







![{\displaystyle {\mathsf {BiBr_{3}+KBr\ {\xrightarrow {}}\ K[BiBr_{4}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60aef68f9efae980970903f5a5f4c5f5dd8775b6)