
Имму́нная систе́ма — система биологических структур и процессов организма, обеспечивающая его защиту от инфекций, токсинов и злокачественных клеток. Для правильной работы иммунной системы необходимо, чтобы она умела распознавать широкий спектр патогенов — от вирусов до многоклеточных паразитов — и отличать их от собственных здоровых тканей организма. У многих видов имеются две подсистемы: врождённая иммунная система и приобретённая (адаптивная) иммунная система. Обе подсистемы используют как гуморальные механизмы, так и клеточные механизмы. К числу древнейших механизмов иммунной системы животных относят фагоцитоз, систему комплемента и антимикробные пептиды. Адаптивная иммунная система в ходе эволюции появилась у челюстноротых позвоночных животных. Один из важнейших механизмов адаптивной иммунной системы — иммунологическая память, благодаря которой организм развивает более сильный иммунный ответ на патоген после первой встречи с ним. Основу вакцинации составляет именно иммунологическая память.

Протеасо́ма — многобелковый комплекс, разрушающий ненужные или дефектные белки при помощи протеолиза до коротких пептидов. Эти пептиды затем могут быть расщеплены до отдельных аминокислот. Протеасомы присутствуют в клетках эукариот, архей и некоторых бактерий. В эукариотических клетках протеасомы содержатся и в ядре, и в цитоплазме. Деградация 80—90 % внутриклеточных белков происходит при участии протеасомы. Для того чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитинлигазами. Присоединение первой молекулы убиквитина к белку служит для убиквитинлигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени. В целом вся эта система получила название убиквитин-зависимой деградации белка.
Белки группы polycomb — это семейство белков, которые способны ремоделировать хроматин. Эти белки-регуляторы были впервые описаны у дрозофил, где они подавляют гомеозисные гены, контролирующие индивидуальные отличия сегментов развивающегося эмбриона.
Сигнальный путь Wnt — один из внутриклеточных сигнальных путей животных, регулирующий эмбриогенез, дифференцировку клеток и развитие злокачественных опухолей.

Myc, или протоонкогенный белок Myc, — фактор транскрипции, который у человека кодируется геном MYC. Myc регулирует экспрессию до 15 % всех генов, связывается с энхансерными последовательностями в ДНК (E-boxes) и усиливает активность ацетилтрансфераз гистонов. Таким образом, Myc не только является классическим примером фактора транскрипции, но и регулирует структуру хроматина, изменяя ацетилирование гистонов в участках, богатых генами, а также в некодирующих районах.

DDR1 — мембранный белок, фермент из надсемейства рецепторных тирозинкиназ, продукт гена DDR1.
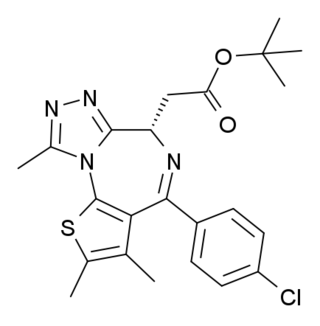
JQ1 — органическое соединение, структурный аналог бензодиазепинов, эффективный, специфичный и легко проникающий в клетку ингибитор белков семейства BET, взаимодействующий с бромодоменами. Широко используется в качестве фармакологического инструмента в эпигенетических исследованиях.

Экзосомы — микроскопические внеклеточные везикулы (пузырьки) диаметром 30—100 нанометров, выделяемые в межклеточное пространство клетками различных тканей и органов. Полость экзосом имеет цитоплазматическое происхождение и содержит белки, РНК и липиды, мембрана экзосом образуется в результате впячивания внутрь эндосомальной мембраны.

Бромодоменсодержащий белок 4 — хроматинсвязывающий белок, который у человека кодируется геном BRD4. Он узнаёт и связывается с остатками ацетилированного лизина в составе гистонов и других белков. BRD4 принимает участие в регуляции транскрипции и передаче эпигенетической информации при делении клетки. В 2016 году было установлено, что BRD4 обладает собственной гистонацетилтрансферазной активностью.
Семейство белков BET — семейство белков, содержащих два тандемных бромодомена на N-конце молекулы и экстратерминальный домен. Белки семейства BET являются глобальными корегуляторами транскрипции. Они связывают ε-аминоацетильные группы остатков лизина в гистонах и привлекают в этот комплекс белки ремоделирования хроматина, соответственно они могут выступать в роли коактиваторов или корепрессоров транскрипции в зависимости от молекулярного контекста. Бромодомены белков семейства BET характеризуются относительно низкой аффинностью к одиночным остаткам ацетиллизина к полипептидах и гораздо большей к участкам со множественными сайтами ацетилирования.

CREB-свя́зывающий бело́к — белок, который у человека кодируется геном CREBBP, локализованным на 16-й хромосоме. CBP функционирует как транскрипционный коактиватор, то есть посредством белок-белковых взаимодействий связывает различные белковые трансактиваторы транскрипции с основным транскрипционным комплексом. Впервые описан исследователями в 1993 году.

Циклинзави́симая кина́за 2 — фермент, кодируемый у человека геном CDK2.
Фа́ктор транскри́пции E2F1 — белок, кодируемый у человека геном E2F1.

Кулли́ны — семейство гидрофобных белков, служащих скэффолдом для убиквитинлигаз (E3). Все эукариоты, как представляется, имеют куллины. Они в сочетании с RING-белками образуют куллин-RING убиквитинлигазы (CRL), которые весьма разнообразны и играют роль во многих клеточных процессах, например, протеолизе, эпигенетической регуляции, работе иммунитета растений, опосредованного салициловой кислотой.
Сигна́л я́дерной локализа́ции — участок молекулы белка, необходимый и достаточный для его локализации в ядре клетки. Сигнал ядерной локализации — это место узнавания белка транспортными факторами — кариоферинами (транспортинами), которые осуществляют его перенос в ядро.

CDCP1 — мембранный белок, регулятор клеточной адгезии. Продукт гена человека CDCP1.

Каспаза 8 — протеолитический фермент, одна из каспаз, кодируется одноимённым геном CASP8, который у человека локализован на коротком плече (p-плече) 2-ой хромосомы. Является экзекуторной (эффекторной) каспазой. Скорее всего, действует на каспазу 3. Ортологи CASP8 были идентифицированы у многочисленных видов млекопитающих, для которых имеются полные данные генома. Эти уникальные ортологи также присутствуют у птиц.

Fas-ассоциированный белок с доменом смерти или белок, взаимодействующий с доменом смерти Fas-рецептора, также называемый MORT1 — адаптерный белок, кодируется одноимённым геном FADD, у человека он локализован на длинном плече (q-плече) 11-ой хромосомы.

Fas-рецептор, также известный как апоптозный антиген 1, кластер дифференцировки 95 (CD95) или член суперсемейства рецепторов фактора некроза опухолей 6 (TNFRSF6) — белок, который у людей кодируется геном FAS. Впервые Fas был идентифицирован с использованием моноклональных антител, полученных путём иммунизации мышей клеточной линией FS-7. Таким образом, название Fas происходит от FS-7-ассоциированного поверхностного антигена.

HAVCR2, или TIM-3 — мембранный белок, продукт гена HAVCR2.
















