Вемурафениб
| Вемурафениб | |
|---|---|
 | |
 | |
| Химическое соединение | |
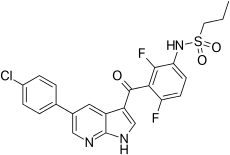
| ИЮПАК | N-(3-{[5-(4-Chlorophenyl)-1H-pyrrolo[2,3-b]pyridin-3-yl]carbonyl}-2,4-difluorophenyl)propane-1-sulfonamide |
| Брутто-формула | C23H18ClF2N3O3S |
| Молярная масса | 489.92 г/моль |
| CAS | 918504-65-1 |
| PubChem | 42611257 |
| DrugBank | DB08881 |
| Состав | |
| Классификация | |
| АТХ | L01XE15 |
| Способы введения | |
| Орально (таблетки) | |
| Другие названия | |
| Zelboraf | |
Вемурафениб — ингибитор BRAF-киназ с активирующими мутациями в кодоне V600E, разработанный компанией Plexxikon (теперь часть Daiichi-Sankyo) и компанией Genentech для лечения поздних стадий меланомы[1]. Наименование вемурафениб происходит от V600E mutated BRAF inhibition. Распространяется под торговой маркой Зелбораф (Zelboraf).
Допуск к применению
17 августа 2011 года вемурафениб был допущен FDA к применению для лечения поздних стадий меланомы[2], став первым препаратом, созданным на основе фрагментного подхода[англ.], получившим одобрение регулятора[3].
15 февраля 2012 года вемурафениб был допущен к применению Министерством здравоохранения Канады[4].
20 февраля 2012 года Европейская комиссия допустила к применению вемурафениб в качестве монотерапии для лечения взрослых пациентов с мутацией BRAF V600E, страдающих неоперабельной или метастатической меланомой, наиболее агрессивной формой рака кожи[5].
Механизм действия
Вемурафениб вызывает запрограммированную смерть клетки в клеточной линии меланомы[6].
Вемурафениб работает только в меланоме пациентов, у которых заболевание было вызвано мутацией V600E BRAF, то есть если на аминокислотной последовательности ДНК, кодирующей белок B-Raf, в позиции № 600 нормальный валин заменён на глутаминовую кислоту[7]. Около 60 % меланом вызваны этой мутацией. Препарат так же эффективен против редкой мутации V600K в том же гене. Клетки меланомы без этих мутаций не ингибируются вемурафенибом; препарат парадоксально стимулирует нормальный B-Raf белок и может способствовать росту опухоли в таком случае[8][9].
Устойчивость
Были обнаружены три механизма устойчивости к вемурафенибу (покрытие 40 % случаев):
- В раковых клетках происходит гиперэкспрессия гена клеточного поверхностного белка PDGFRB, создавая альтернативный путь для выживания.
- Второй онкоген под названием NRAS видоизменяется, повторно активируя нормальный путь выживания BRAF[10].
- Секреция стромальными клетками фактора роста гепатоцита (HGF)[11][12].
Клинические испытания
В фазе I клинических исследований вемурафенибу (тогда он был известен как PLX4032) удалось снизить количество раковых клеток в более чем половине группы из 16 пациентов с меланомой. В опытной группе среднее время выживания увеличилось на 6 месяцев по сравнению с контрольной группой[13][14][15][16].
На втором этапе исследования, которое проходило на пациентах с мутацией V600E в B-Raf, примерно в 80 % случаев удалось добиться частичной или полной регрессии. Регрессия длилась от 2 до 18 месяцев[17].
В начале 2010 года начался I этап испытаний[18] для солидных опухолей (включая колоректальный рак), II фаза испытаний (для метастазирующей меланомы) продолжаются[19].
Фаза III клинических испытаний (по сравнению с дакарбазином) у пациентов с ранее не получавших лечения метастатической меланомы показала улучшение показателей общей и безрецидивной выживаемости[20].
В июне 2011 года положительные результаты были зафиксированы в III фазе исследования при лечении меланомы, вызванной мутацией BRIM3 BRAF[21]. В 2012 году были получены обновлённые хорошие результаты по лечению этой формы меланомы[22].
В следующих исследованиях проведено испытание комбинаций вемурафениба с GDC-0973 (Кобиметиниб[англ.]), с МЕК-ингибиторами[21]. После хороших результатов, полученных в 2014 году, эти комбинации были представлены для одобрения в EC и FDA[23].
В январе 2015 года получены результаты испытания эффективности вемурафениба по сравнению с комбинацией дабрафениба с траметинибом для метастатической меланомы[24].
Побочные эффекты
При максимальной переносимой дозе (МПД) по 960 мг дважды в день 31 % больных получили поражение кожи, которое могло потребовать хирургического удаления[1]. Во второй фазе исследований участвовали 132 пациента; наиболее частыми побочными эффектами были боль в суставах (у 58 % больных), сыпь на коже (у 52 %), фоточувствительность (у 52 %). Для того, чтобы уменьшить проявление побочных эффектов, у 45 % пациентов была изменена дозировка. Медиана суточной дозы составила 1750 мг, (91 % от МПД)[25].
В апреле 2013 года испытания эффективности комбинации ипилимумаба с вемурафенибом были остановлены из-за признаков печёночной токсичности[26].
Примечания
- ↑ 1 2 Bollag G., Hirth P., Tsai J., Zhang J., Ibrahim P. N., Cho H., Spevak W., Zhang C., Zhang Y., Habets G., Burton E. A., Wong B., Tsang G., West B. L., Powell B., Shellooe R., Marimuthu A., Nguyen H., Zhang K. Y., Artis D. R., Schlessinger J., Su F., Higgins B., Iyer R., D'Andrea K., Koehler A., Stumm M., Lin P. S., Lee R. J., Grippo J., Puzanov I., Kim K. B., Ribas A., McArthur G. A., Sosman J. A., Chapman P. B., Flaherty K. T., Xu X., Nathanson K. L., Nolop K. Clinical efficacy of a RAF inhibitor needs broad target blockade in BRAF-mutant melanoma. (англ.) // Nature. — 2010. — Vol. 467, no. 7315. — P. 596—599. — doi:10.1038/nature09454. — PMID 20823850.
- ↑ "FDA Approves Zelboraf (Vemurafenib) and Companion Diagnostic for BRAF Mutation-Positive Metastatic Melanoma, a Deadly Form of Skin Cancer" (Press release). Genentech. Дата обращения: 6 ноября 2016.
{{cite press release}}:|archive-url=требует|archive-date=() - ↑ Bollag G., Tsai J., Zhang J., Zhang C., Ibrahim P., Nolop K., Hirth P. Vemurafenib: the first drug approved for BRAF-mutant cancer. (англ.) // Nature reviews. Drug discovery. — 2012. — Vol. 11, no. 11. — P. 873—886. — doi:10.1038/nrd3847. — PMID 23060265.
- ↑ Notice of Decision for ZELBORAF Архивировано 2 мая 2012 года.
- ↑ Hofland P. First Personalized Cancer Medicine Allows Patients with Deadly Form of Metastatic Melanoma to Live Significantly Longer. Onco'Zine. The International Cancer Network (20 февраля 2012). Архивировано 11 апреля 2012 года.
- ↑ Sala E., Mologni L., Truffa S., Gaetano C., Bollag G. E., Gambacorti-Passerini C. BRAF silencing by short hairpin RNA or chemical blockade by PLX4032 leads to different responses in melanoma and thyroid carcinoma cells. (англ.) // Molecular cancer research : MCR. — 2008. — Vol. 6, no. 5. — P. 751—759. — doi:10.1158/1541-7786.MCR-07-2001. — PMID 18458053.
- ↑ Maverakis E., Cornelius L. A., Bowen G. M., Phan T., Patel F. B., Fitzmaurice S., He Y., Burrall B., Duong C., Kloxin A. M., Sultani H., Wilken R., Martinez S. R., Patel F. Metastatic melanoma - a review of current and future treatment options. (англ.) // Acta dermato-venereologica. — 2015. — Vol. 95, no. 5. — P. 516—524. — doi:10.2340/00015555-2035. — PMID 25520039.
- ↑ Hatzivassiliou G., Song K., Yen I., Brandhuber B. J., Anderson D. J., Alvarado R., Ludlam M. J., Stokoe D., Gloor S. L., Vigers G., Morales T., Aliagas I., Liu B., Sideris S., Hoeflich K. P., Jaiswal B. S., Seshagiri S., Koeppen H., Belvin M., Friedman L. S., Malek S. RAF inhibitors prime wild-type RAF to activate the MAPK pathway and enhance growth. (англ.) // Nature. — 2010. — Vol. 464, no. 7287. — P. 431—435. — doi:10.1038/nature08833. — PMID 20130576.
- ↑ Halaban R., Zhang W., Bacchiocchi A., Cheng E., Parisi F., Ariyan S., Krauthammer M., McCusker J. P., Kluger Y., Sznol M. PLX4032, a selective BRAF(V600E) kinase inhibitor, activates the ERK pathway and enhances cell migration and proliferation of BRAF melanoma cells. (англ.) // Pigment cell & melanoma research. — 2010. — Vol. 23, no. 2. — P. 190—200. — doi:10.1111/j.1755-148X.2010.00685.x. — PMID 20149136.
- ↑ Nazarian R., Shi H., Wang Q., Kong X., Koya R. C., Lee H., Chen Z., Lee M. K., Attar N., Sazegar H., Chodon T., Nelson S. F., McArthur G., Sosman J. A., Ribas A., Lo R. S. Melanomas acquire resistance to B-RAF(V600E) inhibition by RTK or N-RAS upregulation. (англ.) // Nature. — 2010. — Vol. 468, no. 7326. — P. 973—977. — doi:10.1038/nature09626. — PMID 21107323.
- ↑ Straussman R., Morikawa T., Shee K., Barzily-Rokni M., Qian Z. R., Du J., Davis A., Mongare M. M., Gould J., Frederick D. T., Cooper Z. A., Chapman P. B., Solit D. B., Ribas A., Lo R. S., Flaherty K. T., Ogino S., Wargo J. A., Golub T. R. Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion. (англ.) // Nature. — 2012. — Vol. 487, no. 7408. — P. 500—504. — doi:10.1038/nature11183. — PMID 22763439.
- ↑ Wilson T. R., Fridlyand J., Yan Y., Penuel E., Burton L., Chan E., Peng J., Lin E., Wang Y., Sosman J., Ribas A., Li J., Moffat J., Sutherlin D. P., Koeppen H., Merchant M., Neve R., Settleman J. Widespread potential for growth-factor-driven resistance to anticancer kinase inhibitors. (англ.) // Nature. — 2012. — Vol. 487, no. 7408. — P. 505—509. — doi:10.1038/nature11249. — PMID 22763448.
- ↑ "Drug hope for advanced melanoma". BBC News. 2009-06-02. Архивировано 5 июня 2009. Дата обращения: 7 июня 2009.
- ↑ Harmon, Amy (2010-02-21). "A Roller Coaster Chase for a Cure". The New York Times. Архивировано 10 февраля 2017. Дата обращения: 29 сентября 2017.
- ↑ Garber K. Cancer research. Melanoma drug vindicates targeted approach. (англ.) // Science (New York, N.Y.). — 2009. — Vol. 326, no. 5960. — P. 1619. — doi:10.1126/science.326.5960.1619. — PMID 20019269.
- ↑ Flaherty K. Phase I study of PLX4032: Proof of concept for V600E BRAF mutation as a therapeutic target in human cancer. 2009 ASCO Annual Meeting Abstract, J Clin Oncol 27:15s, 2009 (suppl; abstr 9000). Дата обращения: 6 ноября 2016. Архивировано из оригинала 27 января 2013 года.
- ↑ Flaherty K. T., Puzanov I., Kim K. B., Ribas A., McArthur G. A., Sosman J. A., O'Dwyer P. J., Lee R. J., Grippo J. F., Nolop K., Chapman P. B. Inhibition of mutated, activated BRAF in metastatic melanoma. (англ.) // The New England journal of medicine. — 2010. — Vol. 363, no. 9. — P. 809—819. — doi:10.1056/NEJMoa1002011. — PMID 20818844.
- ↑ Safety Study of PLX4032 in Patients With Solid Tumors. ClinicalTrials.gov. Дата обращения: 6 ноября 2016. Архивировано 13 июня 2011 года.
- ↑ A Study of RO5185426 in Previously Treated Patients With Metastatic Melanoma. ClinicalTrials.gov (15 февраля 2010). Дата обращения: 6 ноября 2016. Архивировано 13 июня 2011 года.
- ↑ "Plexxikon Announces First Patient Dosed in Phase 3 Trial of PLX4032 (RG7204) for Metastatic Melanoma" (Press release). Plexxikon. 2010-01-08. Архивировано 1 декабря 2020. Дата обращения: 6 ноября 2016.
- ↑ 1 2 "Plexxikon and Roche Report Positive Data from Phase III BRAF Mutation Melanoma Study". 2011-06-06. Архивировано 31 июля 2018. Дата обращения: 6 ноября 2016.
- ↑ Vemurafenib Improves Overall Survival in Patients with Metastatic Melanoma. Дата обращения: 6 ноября 2016. Архивировано из оригинала 11 января 2022 года.
- ↑ Cobimetinib at exelixis.com Архивная копия от 4 февраля 2015 на Wayback Machine
- ↑ MEK/BRAF Inhibitor Combo Reduces Death by One-Third in Melanoma (2015). Дата обращения: 6 ноября 2016. Архивировано из оригинала 27 декабря 2015 года.
- ↑ BRIM-2 Upholds Benefits Emerging with Vemurafenib in Melanoma (англ.) // Oncology & Biotech News : journal. — 2011. — July (vol. 5, no. 7). Архивировано 31 июля 2018 года.
- ↑ "Getting close and personal". 2014-01-04. Архивировано 2 апреля 2016. Дата обращения: 15 апреля 2016.
Ссылки
- Zelboraf. Label and Approval History (англ.). fda.gov (17 августа 2011). Дата обращения: 6 ноября 2016.
- Vemurafenib (англ.). drugs.com. Дата обращения: 6 ноября 2016.
- Вемурафениб (Vemurafenib). rlsnet.ru. Дата обращения: 6 ноября 2016.