Вирус Сендай
| Вирус Сендай | |
|---|---|
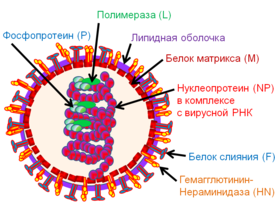 Схема вирусной частицы | |
| Научная классификация | |
Реалм: Царство: Тип: Подтип: Класс: Порядок: Семейство: Подсемейство: Род: Вид: Вирус Сендай | |
| Международное научное название | |
| Murine respirovirus | |
| Синонимы | |
| |
| Группа по Балтимору | |
| V: (-)оцРНК-вирусы | |
Вирус Сендай[3][4][5], или вирус парагриппа мышей[4], или вирус парагриппа 1[5] (лат. Murine respirovirus, ранее Sendai virus), — вид вирусов из семейства парамиксовирусов[6]. Вирус является цитоплазматическим. Его геном, который представлен однонитевой нефрагментированной (-)РНК длиной 15 384 нуклеотидов, реплицируется в цитоплазме. Вирионы имеют сферическую форму размером 150—250 нм[7]. Вирус Сендай вызывает легко передающуюся инфекцию дыхательных путей у мышей, хомяков, морских свинок и крыс. Случаи инфекционных заболеваний, вызванные этим вирусом у человека, кошек, собак или сельскохозяйственных животных, не зарегистрированы. Вирус Сендай широко распространен в природе и встречается в мышиных колониях по всему миру[8] .
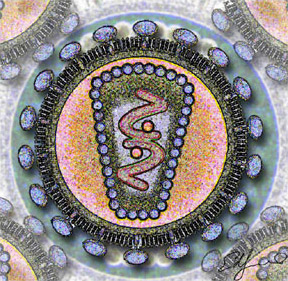
Структура вириона
Вирус Сендай является оболочечным вирусом: внешний слой представлен липидной оболочкой, в которой находятся: гликопротеин Гемагглютинин-Нейроминидаза (HN) с двумя ферментативными активностями (гемагглютинирующей[9] и нейраминидазной), которые необходимы для адсорбции вируса на поверхности клетки-хозяина. Гликопротеин HN является мощным индуктором интерферона 1-го типа. В липидной оболочке вируса также находится белок слияния (F), который тоже является гликопротеином и обеспечивает проникновение вируса в клетки-хозяева после вирусной адсорбции. Белок F- производится в клетке в неактивной форме, однако, за счет протеаз, производимых клетками хозяевами, он расщепляется и превращается в биологически активную форму[6]. Под липидной мембраной расположен матриксный белок (M), он формирует внутренний слой оболочки вируса. Вирус также содержит геномную РНК в комплексе с тремя белками, а именно Нуклеопротеином (NP), Фосфопротеином (P) и Полимеразой (L)[6].
Структура генома
Геном вируса Сендай представляет собой несегментированную РНК отрицательной полярности длиной 15384 нуклеотида и содержит некодирующие 3-штрих и 5-штрих области длиной около 50 нуклеотидов. Они являются цис-элементами, необходимыми для репликации (как и у других респировирусов из семейства Paramyxoviridae). Последовательность генов вируса Сендай выглядит следующим образом: три штрих-N-P-M-F-HN-L-пять штрих. Эти гены кодируют соответственно белок нуклеокапсида (N), малую субъединицу РНК-полимеразы или фосфопротеин (P), матриксный белок (M), белок слияния (F), гемагглютинин-нейраминидазу (HN) и большую субъединицу РНК-полимеразы (L). Дополнительные белки, которые часто называют неструктурными или вспомогательными белками, закодированы в альтернативных рамках считывания гена Р. Матричная РНК вируса Сендай P/C содержит пять участков инициации рибосом между позициями 81 и 201 с 5-штрих конца. Один из этих сайтов находится в открытой рамке считывания белка P, тогда как четыре других представляют собой вложенный набор белков C (C-штрих, C, Y1, Y2). Вирус Сендай использует рибосомное шунтирование для экспрессии белков Y1 и Y2, которые инициируются соответственно на четвёртом и пятом старт-кодонах P/C мРНК. В таких P/C мРНК также закодированы дополнительные белки. Два из них, V и W, являются продуктами редактирования мРНК в кодоне 317 (котранскрипционно добавляются соответственно один или два гуаниловых нуклеотида). Третий – Х-белок – представляет собой C-концевые 95 аминокислот белка Р. Его синтез инициируется рибосомами независимо. Все эти белки являются неструктурными и выполняют несколько функций, включая организацию синтеза вирусной РНК и помощь в избегании врождённого иммунитета хозяина. Также было обнаружено, что белок C способствует почкованию вирусных частиц, а небольшие количества белка C связаны с вирусным капсидом.
Клеточное сливание (образование синцития)
Одной из интересных особенностей вируса Сендай является способность индуцировать образование синцитиев (многоядерных клеточных образований) в природных условиях и в клеточных культурах. Некоторые представители парамиксовирусов, включая вирус Сендай, выработали механизм распространения инфекции путем слияния инфицированных и неинфицированных клеток. При таком распространении инфекции вирус избегает нейтрализующих антител организма хозяина. Механизм этого процесса достаточно хорошо изучен, он похож на процесс слияния, используемый вирионом для проникновения в клетку. Функционирование двух вирусных гликопротеинов HN и F необходимо для обеспечения прохождения этого процесса[10][11][12]. Свойство вируса Сендай сливать мембраны клеток с образованием синцития было использовано учеными для производства гибридом и моноклональных антител. Авторами изобретения являются Жорж Кёлер и Сесар Мильштейн. Они опубликовали соответствующую статью в 1975 году[13], а в 1984 году за свое изобретение они получили Нобелевскую премию по физиологии и медицине. С тех пор были найдены более эффективные методы создания клеточных гибридов[14][15], однако первые гибридомы были получены с помощью вируса Сендай.
Применение
Использование в производстве лейкоцитарного интерферона
Вирус Сендай обладает свойством индуцировать продукцию интерферона альфа в лейкоцитах животных и человека. Это свойство вируса используется для промышленного производства интерферона из лейкоцитов, полученных из донорской крови. Предложение о таком использовании вируса и экспериментальное доказательство такой возможности было сделано в научной работе Кари Кантелла опубликованной в 1981 году[16].Лейкоцитарный интерферон является лекарственным препаратом[17].

Потенциальное использование вируса как онколитического агента
Одним из преимуществ вируса Сендай как потенциального онколитического агента является его безопасность. Несмотря на то, что вирус, в течение десятилетий, широко использовался в лабораторных исследованиях во всем мире, он никогда не провоцировал заболеваний у человека. Более того, вирус Сендай, в процессе клинических испытаний, после закапывания в нос взрослым и детям, не вызывал существенных побочных эффектов, но иммунизировал испытуемых к вирусу человеческого парагриппа 1-го типа[18][19]. Это связано с тем, что вирус Сендай и вирус человеческого парагриппа 1 вызывают образование перекрестных антител[18][19]. Ряд работ, проведенных в Японии, показал, что видоизмененный генно-инженерными методами, вирус Сендай может интенсивно распространяться в опухолевых клетках и уничтожать их, не затрагивая окружающие их нормальные клетки. Онколитическое действие вируса приводило к подавлению роста опухолей, состоящих из клеток человека у лабораторных животных. Новообразования на которые воздействовал вирус Сендай включают опухоли образованные клетками фибросаркомы[20], рака толстой кишки, поджелудочной железы[21] и мозга[22]. Также было показано, что рекомбинантный вирус Сендай с высокой эффективностью уничтожает опухоли меланомы, нейробластомы[23], плоскоклеточного рака, рака печени и простаты[24]. Кроме того, после инактивации ультрафиолетом, при внутриопухолевом введении, вирус Сендай часто оказывал иммуностимулирующее действие. Это действие помогало вирусу подавлять рост опухолей у модельных животных, включая, рак толстой кишки[25][26], мочевого пузыря[27], почки[28] и простаты[29]. Описаны полные и частичные ремиссии опухолей тучных клеток (мастоцитом) у собак вызванные исключительно введением немодифицированного вируса Сендай[30]. Кратковременная ремиссия после внутривенной инъекции живого вируса Сендай была описана у пациента с острой лейкемией в США в 1964 году[31]. Подробно механизмы противоракового действия вируса Сендай описаны в обзорной работе под названием "Механизмы онколитического действия парамиксовируса Сендай"[32].
Применение вируса Сендай в качестве вектора
Вирус Сендай известен научному сообществу более 60 лет. Почти все это время он активно использовался как модельный патоген в молекулярно биологических исследованиях. За последние три десятилетия интерес ученых был сфокусирован на этом вирусе как векторе для создания разнообразного набора генно-инженерных конструктов, включая конструкты для доставки трансгенов в клетку[33][34]. За счет того, что репликация вируса происходит исключительно в цитоплазме, риск генетической интеграции вирусного генома в геном хозяина отсутствует, такая интеграция является проблемой для многих других вирусных векторов.
Добавление, удаление и модификация генов
Рекомбинантные варианты вируса Сендай были созданы путем удаления некоторых вирусных генов таких как белок сливания, матриксный белок и белок геммагглютинин-нейраминидазы так и путем введения в вирусный геном новых генов[35][36][37]. Вирусные конструкты так же создавались и путем модифиции в геноме вируса коротких участков ДНК. Например, был модифицирован фрагмент ДНК, кодирующий вирусный белок сливания (F)[38][39]. Белок сливания представляет собой мембранный гликопротеин типа I, который синтезируется в качестве неактивного предшественника (F0). Этот предшественник должен активироваться протеолитическим расщеплением по остатку аргинина-116[40]. После расщепления предшественник F0 дает две дисульфид-связанные субъединицы F1 и F2. В некоторых генно-инженерных экспериментах сайт протеолитического расщепления F0 изменяли, что приводило к тому, что изменялся набор протеаз-клетки хозяина которые были способны разрезать и активировать F0[41]. В результате, менялась тропность вируса. Он мог размножаться только в тех клетках, которые экспрессировали соответствующие протеазы[38][39].

Визуализация вирусной инфекции в клетке и в организме
Для того чтобы наблюдать за инфекцией и распространением вируса Сендай прямо, непосредственно у живого животного был создан набор различных рекомбинантных конструктов[42][43]. Они позволяют изучать как динамику распространения вируса, так и его исчезновения в процессе выздоровления животного. Некоторые конструкты были созданы для экспрессии зеленого флуоресцентного белка (GFP)[44][45][46][47]. Один из них, rSeV-GFP4, доступен коммерчески и имеется в продаже. Некоторые другие конструкты были созданы для экспрессии красного флуоресцентного белка RFP[47][48]. Кроме того, были созданы конструкты для экспрессии гена люциферазы[49][42][43].
Перепрограммирование в индуцированные стволовые клетки (иСК)
Одним из вариантов применения векторных конструктов на основе вируса Сендай является перепрограммирование соматических клеток в иСК[50][51]. Полученные перепрограммированные клетки в конечном счете не экспрессируют трансгены[52]. Система для такого перепрограммирования доступна для приобретения от ThermoFisher Scientific как CTS CytoTune-iPS 2.1 Sendai Reprogramming Kit, каталожный номер: A34546 [1].
Применение вируса Сендай в качестве вектора для создания вакцины
Вирус Сендай имеет несколько особенностей, которые необходимы для векторной системы, на основе которой может быть создана эффективная вакцина: вирус не интегрируется в геном хозяина, он не подвергается генетической рекомбинации и он реплицируется только в цитоплазме без промежуточных генетических продуктов в ядре клетки. Вирус Сендай, как и все другие представители семейства парамиксовирусов эволюционирует очень медленно и генетически стабилен. Геном вируса чрезвычайно похож на геном вируса парагриппа человека 1 (Human Para-influenza Virus -1 (HPIV-1)), и оба вируса имеют общие антигенные детерминанты. В качестве вакцины для иммунизации против HPIV-1 вирус Сендай дикого типа использовался в клинических испытаниях с участием как взрослых[53], так и детей[54]. Вирус закапывали испытуемым в нос в дозах в диапазоне от 5 × 105 до 5 × 107 50% инфекционной эмбриональной дозы. Такого рода вакцинация приводила к выработке нейтрализующих антител к вирусу парагриппа человека 1 и не вызывала каких-либо ощутимых побочных эффектов. На основании этих испытаний можно заключить, что вирус Сендай безопасен для людей.
На основе вектора вируса Сендай разрабатывается вакцина против СПИДа. Эта разработка достигла второй фазы клинических испытаний. Большинство людей в детстве переболевают вирусом парагриппа 1, поэтому они во взрослом состоянии обычно имеют антитела к HPIV-1. Поскольку антитела к вирусу Сендай, перекрестны с антителами к HPIV-1, то они присутствуют у большинства людей, однако при этом не имеют высокого титра. Исследование, которое было опубликовано в 2011 году, продемонстрировало, что нейтрализующие антитела к вирусу Сендай (которые образовались в результате перенесенной HPIV-1 инфекции) могут быть обнаружены у 92,5% людей во всем мире со средним титром EC50 60,6 и значениями в диапазоне от 5,9 до 11,324[55]. Однако ученые считают, что эти антитела не должны помешать выработке иммунного ответа против вируса иммунодефицита [56]. Такой вывод делается на основании исследования, в котором вакцина, созданная на основе вируса Сендай (SeV), проверялась на способность вызывать формирование специфического к вирусу иммунодефицита Т-клеточного ответа, даже если у организма уже есть антитела против самого вируса Сендай. Такие антитела теоретически могут снижать эффективность вакцин. В исследовании использовали макак-резусов, которых вакцинировали рекомбинантным вектором SeV дважды с перерывом более года. Оказалось, что даже после второй вакцинации, когда у макак уже были антитела против SeV, организм всё равно вырабатывал Т-клетки, которые могли бороться с вирусом. Это означает, что даже если в организме есть антитела против вируса-вектора, вакцинация может быть эффективной и вызывать нужный иммунный ответ [57]. Хотя, следует отметить, что некоторые исследователи все таки предлагают первую вакцинацию (праймирование иммунного ответа) и вторую (бустирование иммунного ответа) делать вакцинами на основе разных векторных конструкций[58]. Подробно о преимуществах вируса Сендай как вакцинного вектора для возможной вакцины против коронавируса SARS-CoV-2 можно прочитать в работе "Обзор технологий для создания вакцин против бетакоронавирусов и вирус Сендай как возможный вакцинный вектор"[2] которая была опубликована в журнале "Молекулярная Биология"[59].
Примечания
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ ICTV Taxonomy history: Murine respirovirus на сайте ICTV (англ.) (Дата обращения: 30 июня 2019).
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии : Учебное пособие для студентов медицинских вузов / Под ред. А. А. Воробьева, А. С. Быкова. — М. : Медицинское информационное агентство, 2003. — С. 126. — 236 с. — ISBN 5-89481-136-8.
- ↑ 1 2 Пиневич А. В., Сироткин А. К., Гаврилова О. В., Потехин А. А. Вирусология : учебник. — СПб. : Издательство Санкт-Петербургского университета, 2012. — С. 393. — ISBN 978-5-288-05328-3.
- ↑ 1 2 Сергеев В. А., Непоклонов Е. А., Алипер Т. И. Вирусы и вирусные вакцины. — М. : Библионика, 2007. — С. 381—382. — ISBN 5-98685-012-2.
- ↑ 1 2 3 The Biology of Paramyxoviruses. www.caister.com. Дата обращения: 11 июня 2019. Архивировано 19 мая 2020 года.
- ↑ Infectious diseases of mice and rats. — Washington, D.C.: National Academy Press, 1991. — 1 online resource (xi, 397 pages) с. — ISBN 0585060274, 9780585060279.
- ↑ Editorial Board // Research in Veterinary Science. — 2013-04. — Т. 94, вып. 2. — С. i. — ISSN 0034-5288. — doi:10.1016/s0034-5288(13)00034-9.
- ↑ гамагглютинация. большая медицинская энциклопедия. Дата обращения: 16 июня 2022. Архивировано 20 сентября 2020 года.
- ↑ D. Hoekstra, K. Klappe, H. Hoff, S. Nir. Mechanism of fusion of Sendai virus: role of hydrophobic interactions and mobility constraints of viral membrane proteins. Effects of polyethylene glycol // The Journal of Biological Chemistry. — 1989-04-25. — Т. 264, вып. 12. — С. 6786–6792. — ISSN 0021-9258.
- ↑ T. Takimoto, G. L. Taylor, H. C. Connaris, S. J. Crennell, A. Portner. Role of the Hemagglutinin-Neuraminidase Protein in the Mechanism of Paramyxovirus-Cell Membrane Fusion (англ.) // Journal of Virology. — 2002-12-15. — Vol. 76, iss. 24. — P. 13028–13033. — ISSN 0022-538X. — doi:10.1128/JVI.76.24.13028-13033.2002.
- ↑ S. L. Novick, D. Hoekstra. Membrane penetration of Sendai virus glycoproteins during the early stages of fusion with liposomes as determined by hydrophobic photoaffinity labeling. (англ.) // Proceedings of the National Academy of Sciences. — 1988-10-01. — Vol. 85, iss. 20. — P. 7433–7437. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.85.20.7433.
- ↑ G. Köhler, C. Milstein. Continuous cultures of fused cells secreting antibody of predefined specificity // Nature. — 1975-08-07. — Т. 256, вып. 5517. — С. 495–497. — ISSN 0028-0836. Архивировано 10 июня 2019 года.
- ↑ Jian Yang, Ming Hong Shen. Polyethylene Glycol-Mediated Cell Fusion (англ.) // Nuclear Reprogramming. — New Jersey: Humana Press, 2005-12-05. — Vol. 325. — P. 59–66. — ISBN 9781597450058. — doi:10.1385/1-59745-005-7:59.
- ↑ Filippo Pedrazzoli, Iraklis Chrysantzas, Luca Dezzani, Vittorio Rosti, Massimo Vincitorio. Cell fusion in tumor progression: the isolation of cell fusion products by physical methods (англ.) // Cancer Cell International. — 2011. — Vol. 11, iss. 1. — P. 32. — ISSN 1475-2867. — doi:10.1186/1475-2867-11-32. Архивировано 4 июня 2018 года.
- ↑ Kari Cantell, Sinikka Hirvonen, Hanna-Leena Kauppinen, Gunnar Myllylä. [4 Production of interferon in human leukocytes from normal donors with the use of Sendai virus] // Methods in Enzymology. — Academic Press, 1981-01-01. — Т. 78. — С. 29–38.
- ↑ Интерферон человеческий лейкоцитарный. www.microgen.ru. Дата обращения: 12 июня 2019. Архивировано из оригинала 4 июля 2018 года.
- ↑ 1 2 Karen S. Slobod, Jerry L. Shenep, Jorge Luján-Zilbermann, Kim Allison, Brita Brown. Safety and immunogenicity of intranasal murine parainfluenza virus type 1 (Sendai virus) in healthy human adults // Vaccine. — 2004-08-13. — Т. 22, вып. 23—24. — С. 3182–3186. — ISSN 0264-410X. — doi:10.1016/j.vaccine.2004.01.053. Архивировано 15 августа 2019 года.
- ↑ 1 2 Elisabeth Adderson, Kristen Branum, Robert E. Sealy, Bart G. Jones, Sherri L. Surman. Safety and immunogenicity of an intranasal Sendai virus-based human parainfluenza virus type 1 vaccine in 3- to 6-year-old children // Clinical and vaccine immunology: CVI. — 2015-3. — Т. 22, вып. 3. — С. 298–303. — ISSN 1556-679X. — doi:10.1128/CVI.00618-14.
- ↑ Hiroaki Kinoh, Makoto Inoue. New cancer therapy using genetically-engineered oncolytic Sendai virus vector // Frontiers in Bioscience: A Journal and Virtual Library. — 2008-01-01. — Т. 13. — С. 2327–2334. — ISSN 1093-9946.
- ↑ M. Hasegawa, Y. Nagai, A. Iida, Y. Tokusumi, S. Fujikawa. Generation of a recombinant Sendai virus that is selectively activated and lyses human tumor cells expressing matrix metalloproteinases (англ.) // Gene Therapy. — 2004-07. — Vol. 11, iss. 14. — P. 1137–1145. — ISSN 1476-5462. — doi:10.1038/sj.gt.3302272. Архивировано 13 марта 2022 года.
- ↑ Y. Iwadate. Recombinant Sendai Virus Vector Induces Complete Remission of Established Brain Tumors through Efficient Interleukin-2 Gene Transfer in Vaccinated Rats // Clinical Cancer Research. — 2005-05-15. — Т. 11, вып. 10. — С. 3821–3827. — ISSN 1557-3265 1078-0432, 1557-3265. — doi:10.1158/1078-0432.ccr-04-1485.
- ↑ K. Tatsuta, S. Tanaka, T. Tajiri, S. Shibata, A. Komaru. Complete elimination of established neuroblastoma by synergistic action of gamma-irradiation and DCs treated with rSeV expressing interferon-beta gene // Gene Therapy. — 2009-2. — Т. 16, вып. 2. — С. 240–251. — ISSN 1476-5462. — doi:10.1038/gt.2008.161.
- ↑ Yoshikazu Yonemitsu. Immunostimulatory virotherapy using recombinant sendai virus as a new cancer therapeutic regimen // Frontiers in Bioscience. — 2008. — Т. Volume, вып. 13. — С. 4953. — ISSN 1093-4715 1093-9946, 1093-4715. — doi:10.2741/3054.
- ↑ Masayuki Kurooka, Yasufumi Kaneda. Inactivated Sendai Virus Particles Eradicate Tumors by Inducing Immune Responses through Blocking Regulatory T Cells // Cancer Research. — 2007-01-01. — Т. 67, вып. 1. — С. 227–236. — ISSN 1538-7445 0008-5472, 1538-7445. — doi:10.1158/0008-5472.can-06-1615. Архивировано 2 декабря 2008 года.
- ↑ Hirokazu Kawano, Shintarou Komaba, Toshihide Kanamori, Yasufumi Kaneda. A new therapy for highly effective tumor eradication using HVJ-E combined with chemotherapy // BMC Medicine. — 2007-09-21. — Т. 5, вып. 1. — С. 28. — ISSN 1741-7015. — doi:10.1186/1741-7015-5-28.
- ↑ Hirokazu Kawano, Shintaro Komaba, Tsugiko Yamasaki, Mitsuyo Maeda, Yoshimitsu Kimura. New potential therapy for orthotopic bladder carcinoma by combining HVJ envelope with doxorubicin // Cancer Chemotherapy and Pharmacology. — 2007-07-26. — Т. 61, вып. 6. — С. 973–978. — ISSN 1432-0843 0344-5704, 1432-0843. — doi:10.1007/s00280-007-0553-1.
- ↑ Atsuko Fujihara, Masayuki Kurooka, Tsuneharu Miki, Yasufumi Kaneda. Intratumoral injection of inactivated Sendai virus particles elicits strong antitumor activity by enhancing local CXCL10 expression and systemic NK cell activation // Cancer immunology, immunotherapy: CII. — 2008-1. — Т. 57, вып. 1. — С. 73–84. — ISSN 0340-7004. — doi:10.1007/s00262-007-0351-y. Архивировано 21 августа 2019 года.
- ↑ Yoshifumi Kawaguchi, Yasuhide Miyamoto, Takehiro Inoue, Yasufumi Kaneda. Efficient eradication of hormone-resistant human prostate cancers by inactivated Sendai virus particle // International Journal of Cancer. — 2009-05-15. — Т. 124, вып. 10. — С. 2478–2487. — ISSN 1097-0215. — doi:10.1002/ijc.24234.
- ↑ Peter M. Chumakov, Olga V. Matveeva, Alesya V. Soboleva, Elena V. Mukhina, Galina V. Ilyinskaya. Oncolytic Sendai Virus Therapy of Canine Mast Cell Tumors (A Pilot Study) (англ.) // Frontiers in Veterinary Science. — 2018. — Vol. 5. — ISSN 2297-1769. — doi:10.3389/fvets.2018.00116. Архивировано 2 декабря 2020 года.
- ↑ E. F. Wheelock, J. H. Dingle. OBSERVATIONS ON THE REPEATED ADMINISTRATION OF VIRUSES TO A PATIENT WITH ACUTE LEUKEMIA. A PRELIMINARY REPORT // The New England Journal of Medicine. — 1964-09-24. — Т. 271. — С. 645—651. — ISSN 0028-4793. — doi:10.1056/NEJM196409242711302. Архивировано 21 августа 2019 года.
- ↑ Матвеева О.в, Кочнева Г.в, Нетесов С.в, Оникиенко С.б, Чумаков П.м. Механизмы онколитического действия парамиксовируса Сендай // Acta Naturae (русскоязычная версия). — 2015. — Т. 7, вып. 2 (25). — ISSN 2075-8243.
- ↑ Sendai Virus Vector / Yoshiyuki Nagai. — 2013. — doi:10.1007/978-4-431-54556-9.
- ↑ Mahito Nakanishi, Makoto Otsu. Development of Sendai Virus Vectors and their Potential Applications in Gene Therapy and Regenerative Medicine // Current Gene Therapy. — 2012-10. — Т. 12, вып. 5. — С. 410–416. — ISSN 1566-5232. — doi:10.2174/156652312802762518.
- ↑ M. Sugiyama, Y. Kakeji, S. Tsujitani, Y. Harada, M. Onimaru. Antagonism of VEGF by Genetically Engineered Dendritic Cells Is Essential to Induce Antitumor Immunity against Malignant Ascites // Molecular Cancer Therapeutics. — 2011-01-05. — Т. 10, вып. 3. — С. 540–549. — ISSN 1538-8514 1535-7163, 1538-8514. — doi:10.1158/1535-7163.mct-10-0479.
- ↑ Mariko Yoshizaki, Takashi Hironaka, Hitoshi Iwasaki, Hiroshi Ban, Yumiko Tokusumi. Naked Sendai virus vector lacking all of the envelope-related genes: reduced cytopathogenicity and immunogenicity // The Journal of Gene Medicine. — 2006. — Т. 8, вып. 9. — С. 1151–1159. — ISSN 1521-2254 1099-498X, 1521-2254. — doi:10.1002/jgm.938.
- ↑ M. Inoue, Y. Tokusumi, H. Ban, T. Kanaya, M. Shirakura. A New Sendai Virus Vector Deficient in the Matrix Gene Does Not Form Virus Particles and Shows Extensive Cell-to-Cell Spreading // Journal of Virology. — 2003-06-01. — Т. 77, вып. 11. — С. 6419–6429. — ISSN 0022-538X. — doi:10.1128/jvi.77.11.6419-6429.2003.
- ↑ 1 2 320. Oncolytic M Gene-Deficient Sendai Virus Vectors That Selectively Targets and Lyses Human Tumor Cells Expressing Matrix Metalloproteinase by Syncytia Formation // Molecular Therapy. — 2003-05. — Т. 7, вып. 5. — С. S126. — ISSN 1525-0016. — doi:10.1016/s1525-0016(16)40762-8.
- ↑ 1 2 Martina Zimmermann, Sorin Armeanu-Ebinger, Sascha Bossow, Johanna Lampe, Irina Smirnow. Attenuated and Protease-Profile Modified Sendai Virus Vectors as a New Tool for Virotherapy of Solid Tumors // PLoS ONE. — 2014-03-05. — Т. 9, вып. 3. — С. e90508. — ISSN 1932-6203. — doi:10.1371/journal.pone.0090508.
- ↑ P. Faísca, D. Desmecht. Sendai virus, the mouse parainfluenza type 1: A longstanding pathogen that remains up-to-date // Research in Veterinary Science. — 2007-02. — Т. 82, вып. 1. — С. 115–125. — ISSN 0034-5288. — doi:10.1016/j.rvsc.2006.03.009.
- ↑ A. Portner, R. A. Scroggs, C. W. Naeve. The fusion glycoprotein of Sendai virus: Sequence analysis of an epitope involved in fusion and virus neutralization // Virology. — 1987-04. — Т. 157, вып. 2. — С. 556–559. — ISSN 0042-6822. — doi:10.1016/0042-6822(87)90301-1.
- ↑ 1 2 Crystal W. Burke, John N. Mason, Sherri L. Surman, Bart G. Jones, Emilie Dalloneau. Illumination of parainfluenza virus infection and transmission in living animals reveals a tissue-specific dichotomy // PLoS pathogens. — 2011-07. — Т. 7, вып. 7. — С. e1002134. — ISSN 1553-7374. — doi:10.1371/journal.ppat.1002134. Архивировано 27 сентября 2019 года.
- ↑ 1 2 Heba H. Mostafa, Peter Vogel, Ashok Srinivasan, Charles J. Russell. Non-invasive Imaging of Sendai Virus Infection in Pharmacologically Immunocompromised Mice: NK and T Cells, but not Neutrophils, Promote Viral Clearance after Therapy with Cyclophosphamide and Dexamethasone // PLoS pathogens. — 09 2016. — Т. 12, вып. 9. — С. e1005875. — ISSN 1553-7374. — doi:10.1371/journal.ppat.1005875. Архивировано 17 августа 2019 года.
- ↑ D. R. Agungpriyono, R. Yamaguchi, K. Uchida, Y. Tohya, A. Kato. Green fluorescent protein gene insertion of Sendai Virus infection in nude mice: possibility as an infection tracer // The Journal of Veterinary Medical Science. — 2000-02. — Т. 62, вып. 2. — С. 223–228. — ISSN 0916-7250. — doi:10.1292/jvms.62.223. Архивировано 27 октября 2016 года.
- ↑ Rémi Villenave, Olivier Touzelet, Surendran Thavagnanam, Severine Sarlang, Jeremy Parker. Cytopathogenesis of Sendai virus in well-differentiated primary pediatric bronchial epithelial cells // Journal of Virology. — 2010-11. — Т. 84, вып. 22. — С. 11718–11728. — ISSN 1098-5514. — doi:10.1128/JVI.00798-10. Архивировано 9 февраля 2012 года.
- ↑ Masao MIYAZAKI, Hiroaki SEGAWA, Tetsuro YAMASHITA, Yafeng ZHU, Kaoru TAKIZAWA. Construction and Characterization of a Fluorescent Sendai Virus Carrying the Gene for Envelope Fusion Protein Fused with Enhanced Green Fluorescent Protein // Bioscience, Biotechnology, and Biochemistry. — 2010-11-23. — Т. 74, вып. 11. — С. 2293–2298. — ISSN 1347-6947 0916-8451, 1347-6947. — doi:10.1271/bbb.100511.
- ↑ 1 2 Laura Strähle, Jean-Baptiste Marq, Albert Brini, Stéphane Hausmann, Daniel Kolakofsky. Activation of the beta interferon promoter by unnatural Sendai virus infection requires RIG-I and is inhibited by viral C proteins // Journal of Virology. — 2007-11. — Т. 81, вып. 22. — С. 12227–12237. — ISSN 0022-538X. — doi:10.1128/JVI.01300-07. Архивировано 30 мая 2015 года.
- ↑ Masako Abe, Maino Tahara, Kouji Sakai, Hiromi Yamaguchi, Kazuhiko Kanou. TMPRSS2 is an activating protease for respiratory parainfluenza viruses // Journal of Virology. — 2013-11. — Т. 87, вып. 21. — С. 11930–11935. — ISSN 1098-5514. — doi:10.1128/JVI.01490-13. Архивировано 2 марта 2020 года.
- ↑ M K Hasan, Y Nagai, D Yu, Y Sakai, A Kato. Creation of an infectious recombinant Sendai virus expressing the firefly luciferase gene from the 3' proximal first locus. // Journal of General Virology. — 1997-11-01. — Т. 78, вып. 11. — С. 2813–2820. — ISSN 1465-2099 0022-1317, 1465-2099. — doi:10.1099/0022-1317-78-11-2813.
- ↑ Noemi Fusaki, Hiroshi Ban, Akiyo Nishiyama, Koichi Saeki, Mamoru Hasegawa. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome // Proceedings of the Japan Academy. Series B, Physical and Biological Sciences. — 2009. — Т. 85, вып. 8. — С. 348–362. — ISSN 1349-2896. — doi:10.2183/pjab.85.348. Архивировано 16 августа 2019 года.
- ↑ Hiroshi Ban, Naoki Nishishita, Noemi Fusaki, Toshiaki Tabata, Koichi Saeki. Efficient generation of transgene-free human induced pluripotent stem cells (iPSCs) by temperature-sensitive Sendai virus vectors // Proceedings of the National Academy of Sciences of the United States of America. — 2011-08-23. — Т. 108, вып. 34. — С. 14234–14239. — ISSN 1091-6490. — doi:10.1073/pnas.1103509108. Архивировано 17 августа 2019 года.
- ↑ Yasumitsu Fujie, Noemi Fusaki, Tomohiko Katayama, Makoto Hamasaki, Yumi Soejima. New type of Sendai virus vector provides transgene-free iPS cells derived from chimpanzee blood // PloS One. — 2014. — Т. 9, вып. 12. — С. e113052. — ISSN 1932-6203. — doi:10.1371/journal.pone.0113052.
- ↑ Karen S. Slobod, Jerry L. Shenep, Jorge Luján-Zilbermann, Kim Allison, Brita Brown. Safety and immunogenicity of intranasal murine parainfluenza virus type 1 (Sendai virus) in healthy human adults // Vaccine. — 2004-08-13. — Т. 22, вып. 23-24. — С. 3182–3186. — ISSN 0264-410X. — doi:10.1016/j.vaccine.2004.01.053. Архивировано 15 августа 2019 года.
- ↑ Elisabeth Adderson, Kristen Branum, Robert E. Sealy, Bart G. Jones, Sherri L. Surman. Safety and immunogenicity of an intranasal Sendai virus-based human parainfluenza virus type 1 vaccine in 3- to 6-year-old children // Clinical and vaccine immunology: CVI. — 2015-03. — Т. 22, вып. 3. — С. 298–303. — ISSN 1556-679X. — doi:10.1128/CVI.00618-14.
- ↑ Hiroto Hara, Hiroto Hara, Takashi Hironaka, Makoto Inoue, Akihiro Iida. Prevalence of specific neutralizing antibodies against Sendai virus in populations from different geographic areas: implications for AIDS vaccine development using Sendai virus vectors // Human Vaccines. — 2011-06. — Т. 7, вып. 6. — С. 639–645. — ISSN 1554-8619. — doi:10.4161/hv.7.6.15408.
- ↑ Sayuri Seki, Tetsuro Matano. Development of a Sendai virus vector-based AIDS vaccine inducing T cell responses // Expert Review of Vaccines. — 2016. — Т. 15, вып. 1. — С. 119–127. — ISSN 1744-8395. — doi:10.1586/14760584.2016.1105747.
- ↑ Chikaya Moriya, Satoshi Horiba, Makoto Inoue, Akihiro Iida, Hiroto Hara, Tsugumine Shu, Mamoru Hasegawa, Tetsuro Matano. Antigen-specific T-cell induction by vaccination with a recombinant Sendai virus vector even in the presence of vector-specific neutralizing antibodies in rhesus macaques // Biochemical and Biophysical Research Communications. — 2008-07-11. — Т. 371, вып. 4. — С. 850–854. — ISSN 1090-2104. — doi:10.1016/j.bbrc.2008.04.156.
- ↑ Julien Nyombayire, Omu Anzala, Brian Gazzard, Etienne Karita, Philip Bergin. First-in-Human Evaluation of the Safety and Immunogenicity of an Intranasally Administered Replication-Competent Sendai Virus–Vectored HIV Type 1 Gag Vaccine: Induction of Potent T-Cell or Antibody Responses in Prime-Boost Regimens (англ.) // Journal of Infectious Diseases. — 2017-01-01. — Vol. 215, iss. 1. — P. 95–104. — ISSN 1537-6613 0022-1899, 1537-6613. — doi:10.1093/infdis/jiw500.
- ↑ Т. А. Зайчук, Ю. Д. Нечипуренко, А. А. Аджубей, С. Б. Оникиенко, В. А. Черешнев. Проблемы создания вакцин против бетакоронавирусов: антителозависимое усиление инфекции и вирус Сендай как возможный вакцинный вектор // Молекулярная биология. — 2020. — Т. 54, вып. 6. — С. 922–938. — ISSN 0026-8984. — doi:10.31857/s0026898420060154.
Литература
- Горбунова А. С., Хоу Юнь-дэ. Вирус Сендай — возбудитель гриппоподобных заболеваний человека и животных / Акад. мед. наук СССР. — М.: Медицина, 1964. — 196 с.