Вирус гепатита дельта
| Вирус гепатита дельта | |
|---|---|
 | |
| Научная классификация | |
| Международное научное название | |
| Deltavirus italiense | |
| Синонимы | |
| |
| Группа по Балтимору | |
| V: (-)оцРНК-вирусы | |
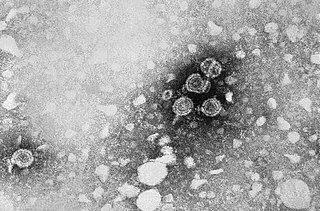
Ви́рус гепати́та де́льта[2], или ви́рус гепати́та D[3] (лат. Deltavirus italiense), — инфекционный агент, вызывающий гепатит D у человека. Строго говоря, этот небольшой РНК-содержащий инфекционный агент является вирусом-сателлитом, поскольку для его размножения в клетках и развития инфекции необходимо, чтобы клетки были заражены вирусом гепатита B (HBV). HDV использует оболочечные белки вируса гепатита B (HBsAg[англ.]) для упаковки своего генома[4][5].
Вирус гепатита дельта изначально был описан у пациентов с более тяжёлой формой инфекции, вызываемой вирусом гепатита B. Заражение гепатитом D может как происходить вместе с заражением гепатитом B (коинфекция), так и накладываться на хронический гепатит B (суперинфекция). В обоих случаях у пациентов проявляются более тяжёлые симптомы по сравнению с одним только гепатитом B. Среди них намного выше вероятность развития терминальной стадии печёночной недостаточности в результате острой инфекции, быстрого развития цирроза печени, а в случае хронических инфекций — увеличенная вероятность гепатоцеллюлярной карциномы[6].
Вирус гепатита дельта уникален среди патогенов человека и животных тем, что он имеет ряд общих свойств как с вироидами растений[7], так и с вироид-подобными сателлитными РНК растений. Этот патоген, передающийся с кровью, размножается в печени и может вызывать острый гепатит как у приматов, так и млекопитающих из числа не-приматов (хотя естественным хозяином вируса является только человек). По всему миру вирусом гепатита дельта заражено более 15 миллионов человек, что делает его важной проблемой современного здравоохранения[5].
История изучения
Первые сообщения о вирусе гепатита дельта появились в середине 1977 года. Его открыл Марио Риццетто[англ.] с коллегами, которые изучали группу пациентов, инфицированных вирусом гепатита B и страдавших от особо острой формы гепатита. Он был описан как новый ядерный антиген[8] вируса гепатита B и назван антигеном дельта (δ, HDAg)[9]. Последующие эксперименты на шимпанзе показали, что дельта-антиген на самом деле является структурным элементом патогена, для репликации которого был необходим вирус гепатита B. До 1980 года вирус гепатита дельта не считали инфекционным агентом. Однако вскоре после признания вируса гепатита дельта патогеном были разработаны эффективные тесты на него. Помимо этого, был открыт сбор эпидемиологической информации по гепатиту D (он начался с южной Италии)[10]. Геном вируса гепатита дельта был клонирован и секвенирован в 1986 году[11][12]. В 1993 году вирус был зарегистрирован Международным комитетом по таксономии вирусов и помещён в монотипный род Deltavirus[13].
Эволюция и происхождение

Естественным хозяином HDV является только человек. Данные филогенетических исследований говорят об африканском происхождении вируса гепатита дельта[14]. HDV характеризуется высокой степенью генетической гетерогенности. Считается, что эволюцию HDV обеспечивают 3 основных механизма: мутации, редактирование и рекомбинация. Скорость мутирования составляет, по разным оценкам, от 3⋅10-2 до 3⋅10-3 замен на геном в год. Она зависит от фазы инфекции (наиболее высока в острой фазе), участка генома (высока в неконсервативных участках и низка в консервативных, например, в области рибозима) и возрастает от терапевтического давления. Скорость мутирования HDV выше, чем у большинства РНК-содержащих вирусов. В связи с такой скоростью мутирования предполагается, что HDV циркулирует в пределах одного заражённого организма-хозяина как ряд квазивидов[15]. Установлено, что до 70 % замен может быть обусловлено редактированием. Впервые рекомбинация у HDV была описана в 1999; тогда был сделан вывод, что она происходит в случае заражения вирусами различных генотипов. Рекомбинация происходит по пути гомологичной рекомбинации[16]. Предполагается, что в рекомбинации у HDV принимает участие РНК-полимераза клетки-хозяина[9].
Первоначально было описано 3 генотипа этого вируса (I—III). Генотип I был выделен в Европе, Северной Америке, Африке и некоторых регионах Азии. Генотип II встречается в Японии, на Тайване, а также в Якутии. Генотип III известен исключительно в Южной Америке (Перу, Колумбия и Венесуэла). Сейчас известно, что существует по меньшей мере 8 генотипов вируса гепатита дельта (HDV-1 — HDV-8). Все они, за исключением HDV-1, приурочены к строго определённым географическим регионам. HDV-2 (ранее известный как HDV-IIa) найден в Японии, на Тайване и в Якутии; HDV-4 (HDV-IIb) — в Японии и на Тайване; HDV-3 — в районе Амазонки; HDV-5, HDV-6, HDV-7 и HDV-8 — в Африке[17].
В настоящее время распространены две основные теории относительно происхождения вируса гепатита дельта. Согласно им, HDV произошёл от вироидов растений и/или в результате сплайсинга пре-мРНК[англ.] клетки-хозяина. РНК HDV по особенностям структуры и репликации имеет общие черты с каждым из двух семейств вироидов, известных на данный момент (Pospiviroidae и Avsunviroidae). С Pospiviroidae этот вирус объединяет палочковидная структура РНК и репликация в ядре, а с Avsunviroidae — наличие рибозима и симметричная репликация по типу катящегося кольца. Более того, РНК HDV и вироидов растений взаимодействуют с гомологичными клеточными белками, а экспериментальные данные 2012 года (правда, не до конца подтверждённые) показывают, что HDV может реплицироваться и размножаться после внедрения в листья проростков томата, что служит ещё одним подтверждением близости HDV и вироидов. Однако эта гипотеза не даёт ответа на вопрос о происхождении дельта-антигена и связи HDV с HBV[9].
Вторая теория, которая может дополнять первую, заключается в том, что HDV мог возникнуть из транскриптома клетки-хозяина. Эта точка зрения подтверждается исследованиями, показавшими, что в клетках человека имеется рибозим (в интроне гена CPEB3), по вторичной структуре и биохимическим свойствам схожий с рибозимом HDV[англ.]. Впрочем, рибозимы, имеющие структурный элемент псевдоузел, были позднее найдены во всех царствах живых организмов, за исключением архей, а также в вирусах насекомых. Для дельта-антигена также предполагается возникновение из клетки-хозяина. Первоначально возможным белком-предком дельта-антигена считали белок DIPA (англ. delta interacting protein A). Хотя впоследствии оказалось, что эти белки не гомологичны, DIPA может взаимодействовать с HDAg[9].
Интегрированная модель предполагает, что HDV мог возникнуть после рекомбинации между вироид-подобным элементом и клеточной пре-мРНК/мРНК[9].
Строение и геном
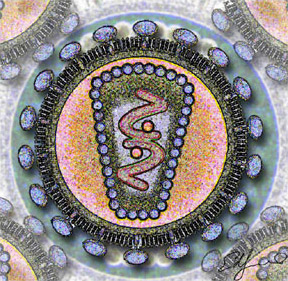
Вирус гепатита дельта представляет собой частицу диаметром 35—37 нм, покрытую поверхностными антигенами вируса гепатита B (HBsAg), имеющую плотность 1,25 г/см³ в градиенте хлорида цезия и характеризующуюся значением коэффициента седиментации, средним между пустыми частицами вируса гепатита B (HBV), состоящими только из HBsAg, и вирионом HBV. Вирион HDV состоит из трёх ключевых компонентов: геномной РНК, связанной с молекулами дельта-антигена (нуклеокапсид), и наружным капсидом, состоящим из поверхностных антигенов гепатита B[англ.][9]. Оболочка HDV содержит липиды и состоит из гликопротеинов HBV трёх видов: малых, или S-HBsAg, средних, или M-HBsAg, и крупных, или L-HBsAg (около 100 копий). У обоих вирусов эти белки служат для проникновения в гепатоциты и выхода из них[9]. Кроме полноценных вирусных частиц, заражённые HDV клетки образуют в большом избытке пустые субвирусные частицы (SVP), которые представлены сферами диаметром 25 нм и филаментами диаметром 22 нм[18].
Роль белков оболочки HBV

Все три формы HBsAg имеют общий C-конец. Около 50 % HBsAg каждого вида подвергаются сайт-специфическому N-гликозилированию[англ.][18]. Кроме S-домена, M-HBsAg содержит N-концевой гидрофильный домен PreS2, а L-HBsAg, кроме PreS2, имеет ещё и домен PreS1. L-HBsAg необходим, хотя и недостаточен, для сборки частиц и инфективности[англ.] HBV, а S-HBsAg необходим для высвобождения частиц из клетки. M-антиген не является необходимым ни для сборки, ни для инфективности[19]. В отличие от HBV, сборка HDV нуждается только лишь в S-HBsAg, однако без L-HBsAg частицы лишены инфективности. Эти различия в необходимых белках объясняются различными доменами связывания с нуклеокапсидом HBV и рибонуклеопротеином HDV на цитозольных петлях белков оболочки. Согласно последним данным, сборка (и инфективность) HDV генотипа HDV-1 не приурочена только к одному генотипу HBV. Она может происходить также в присутствии белков оболочки гепаднавирусов сурка, летучей мыши и шерстистых обезьян[9].
Вирусные РНК

Вирион HDV содержит кольцевой геном, представленный РНК отрицательной полярности[англ.], причём вторичная структура этой РНК содержит двуцепочечные участки[18]. При размножении вируса в инфицированной клетке можно обнаружить две другие главные вирусные РНК: молекулу, комплементарную геномной (антигеномная РНК, или антигено́м), и мРНК HDV. Размер генома HDV составляет всего лишь 1672—1697 нуклеотидов, что делает его мельчайшим из всех известных вирусов млекопитающих и сближает с вироидами растений. Он имеет высокий GC-состав (60 %), а процент внутримолекулярного спаривания оснований достигает 74 %, что позволяет ему сворачиваться в палочковидную структуру. Такие структуры в условиях in vitro устойчивы к разрезанию ферментом Dicer[7]. Заражённая клетка может содержать около 300 000 молекул генома HDV, которые распределены между ядром и цитоплазмой, что свидетельствует о высоких темпах репликации. Антигеномная РНК HDV представляет собой промежуточное соединение в цикле репликации, комплементарна геномной РНК (и, следовательно, имеет положительную полярность) и содержит последовательность, кодирующую HDAg. Её количество в 5—22 раза меньше, чем геномной РНК, она встречается исключительно в ядре и потому не упаковывается в вирионы. Белки HDV транслируются со специфической мРНК длиной 800 нуклеотидов, которая транскрибируется ДНК-зависимой РНК-полимеразой II клетки-хозяина и проходит те же этапы созревания (в том числе кэпирование и полиаденилирование), что и клеточные мРНК[9].
Рибозим
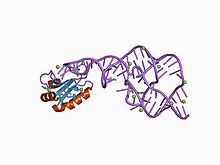
В геномной и антигеномной РНК HDV были найдены небольшие саморазрезающиеся последовательности длиной около 85 нуклеотидов. Эти рибозимы, последовательности которых демонстрируют высокую консервативность среди генотипов HDV, отвечают за разрезание мультимерных молекул РНК, образующихся при репликации. Рибозим HDV имеет уникальные структурные и функциональные характеристики, отличающие его от рибозимов вироидов. Было получено несколько кристаллических структур этих рибозимов, и благодаря им удалось описать механизм разрезания, основанный на псевдоузлах. В условиях in vitro в присутствии ионов двухвалетных металлов рибозим HDV разрезается по специфическому сайту в результате реакции переэтерификации с образованием 5'-OH и 2'-, 3'-циклического монофосфата[18]. Как отмечалось выше, в геномах клеток-хозяев имеются рибозимы, близко напоминающие рибозим HDV[9].
Дельта-антиген

Часть антигеномных РНК вируса гепатита дельта редактируется в ходе репликации — специфический остаток аденозина (в положении 1014) дезаминируется в инозин. Этот процесс осуществляется клеточным ферментом аденозиндезаминазой[англ.] (ADAR1), действующей на РНК. В ходе последующей репликации модифицированный остаток формирует уотсон-криковскую пару с цитозином, а не с уридином, из-за чего исходный аденозин в положении 1014 заменяется на гуанозин. Специфичность редактирования, вероятнее всего, определяется первичной и вторичной структурами РНК вируса гепатита дельта[20].
ADAR1 имеет две изоформы — малую (ADAR1-S) и большую (ADAR1-L), которые имеют одинаковый C-конец. Более широко представлена ADAR1-S, она экспрессируется постоянно и локализована в ядре, в то время как ADAR1-L встречается в основном в цитоплазме и её экспрессия стимулируется интерфероном. Было установлено, что ADAR1-L очень эффективна в редактировании транскриптов в цитоплазме, однако позднее было показано, что редактирование РНК HDV происходит в ядре, а не в цитоплазме, и опосредуется ADAR1-S, которая там локализуется. Впрочем, исследования 2004 и 2006 годов показали, что усиленное редактирование РНК HDV после обработки интерфероном может быть связано с ADAR1-L, а не ADAR1-S[9].
В результате редактирования стоп-кодон UAG, который в норме завершает открытую рамку считывания, останавливая синтез белка на 195-м аминокислотном остатке, заменяется на кодон UGG, который кодирует триптофан. Редактированные антигеномные РНК в ходе репликации дают начало геномным РНК; эти геномные РНК транскрибируются РНК-полимеразой II в модифицированные мРНК. До 30 % мРНК вируса гепатита дельта несут изменённый стоп-кодон. С этих мРНК синтезируется более длинный пептид длиной 214 аминокислотных остатков. Таким образом, вирус гепатита дельта имеет две формы антигена: малую, длиной 195 аминокислотных остатков и массой 24 кДа, и большую, состоящую из 214 аминокислот и имеющую массу 27 кДа. N-концы двух форм одинаковы, различия заключаются в 19 аминокислотных остатках на С-конце[21][20]. У обеих форм на N-конце имеется мотив биспираль[англ.], необходимый для димеризации. Димеры дельта-антигены имеют обогащённый аргинином мотив, который позволяет ему связываться с вирусными РНК. Однако на удлинённом C-конце L-HDAg имеется четыре уникальных остатка цистеина, которые являются мишенью для фарнезилирования. После этой посттрансляционной модификации L-HDAg может взаимодействовать с поверхностными белками HBV и тем самым способствовать сборке новых вирусных частиц[22].
И малая, и большая формы дельта-антигена содержат сигнал ядерной локализации и участки связывания РНК. Некоторые взаимодействия дельта-антигена обеспечиваются мотивом биспираль на N-конце[23]. Несмотря на 90-процентное сходство в последовательностях аминокислот, эти две формы играют разные роли в развитии вирусной инфекции. Малый дельта-антиген необходим для репликации вирусной РНК и функционирует на ранних этапах инфекции, а большой дельта-антиген необходим для упаковки вирусного генома, кроме того, он функционирует как ингибитор репликации вирусной РНК. Поскольку две формы дельта-антигена экспрессируются на разных этапах вирусной инфекции, редактирование РНК нуждается в жёсткой регуляции. Механизмы осуществления этой регуляции в настоящий момент изучены слабо[20].
Рибонуклеопротеин
Геномная РНК HDV связывается с HDAg и образует рибонуклеопротеин, который присутствует как в вирусных частицах, так и в заражённых клетках. Этот рибонуклеопротеин необходим не только для сборки вириона, но также для перемещения РНК HDV между ядром и цитоплазмой. Структура и стехиометрия этого рибонуклеопротеина являются предметом споров. Пионерские исследования показали, что в вирионе геномная молекула связана с 70 молекулами HDAg, в то время как в ядре заражённых клеток и геномная, и антигеномная РНК образуют рибонуклеопротеины с 30 молекулами HDAg. Дальнейшие исследования показали, что и в вирионах, и в заражённых клетках на одну молекулу генома приходится 200 молекул HDAg. Однако эти значения были поставлены под вопрос последними исследованиями, в ходе которых было установлено, что молекулы дельта-антигена олигомеризуются при связывании с РНК; это особенно важно учитывать при малом количестве молекул антигена на РНК. Кроме того, специфичность связывания HDAg к геному, по-видимому, определяется его вторичной структурой, а не первичной[9].
Жизненный цикл

Проникновение в клетку
Гематотропизм HDV и его способность к размножению внутри гепатоцитов связаны с коинфекцией последних HBV. В то время как для сборки вирионов HDV необходима экспрессия поверхностных гликопротеинов HBV в той же клетке, другие аспекты репликации обоих вирусов совершенно не зависят друг от друга. В отличие от HBV, который нуждается в специфичных для печени факторах транскрипции, репликация HDV может происходить в клетках млекопитающих самых разных типов, если геном вируса будет предварительно доставлен в эти клетки. Поскольку структура оболочки HBV и HDV очень похожа, то можно предположить, что и механизмы прикрепления к клетке-мишени и проникновения в неё будут общими у этих вирусов. В самом деле, большая часть имеющейся на данный момент информации о механизмах проникновения HBV в клетку получена из моделей инфекции HDV[9].
Для инфективности обоих вирусов необходим L-HBsAg. Специфические мутации в 75 N-концевых аминокислотных остатках домена Pre-S1 или ингибирование миристоилирования[англ.] могут лишить вирус инфективности. В инфективность также вносит вклад антигеновый петлевой домен S-HBsAg и его паттерн гликозилирования, поскольку мутации в этом домене могут подавить развитие инфекции независимо от домена PreS1[9].
Для проникновения в клетку HBV и HDV должны вначале прикрепиться к её поверхности; это осуществляется за счёт клеточных протеогликанов гепарансульфатов[англ.]. Прикрепление частиц HDV к клетке увеличивалось более чем в 15 раз после обработки 4—5 % полиэтиленгликолем. Конкретные гепарансульфаты, участвующие в прикреплении HDV и HBV, ещё не идентифицированы, хотя в 2015 году было показано, что наиболее важен для этого процесса глипикан-5[англ.]. Этап прикрепления к клетке необходим, но не достаточен для развития инфекции; попадание в клетку вирусов, связанных с гепарансульфатами, ещё может быть подавлено. Более того, после прикрепления к клетке дальнейшее проникновение вируса в клетку идёт гораздо менее быстро. Например, после 3-часового взаимодействия первичных человеческих гепатоцитов с HDV более половины вирусных частиц оставалось на поверхности клетки, а потому были чувствительны к действию ингибиторов, блокирующих проникновение в клетку (например, пептида, соответствующего части домена PreS1 на N-конце L-HBsAg)[24]. Было показано, что прикрепление HDV и HBV к клетке блокировалось сурамином, поэтому, возможно, в процесс прикрепления вовлечены пуринергические рецепторы[англ.][9].
В 2012 году было установлено, что функциональным рецептором для HBV и HDV является контранспортирующий пептид таурохлората натрия (hNTCP, кодируется геном SLC10A1). NTCP располагается в базолатеральной мембране гепатоцитов и участвует во внутрипечёночном перемещении солей жёлчных кислот. Судя по всему, вирусная инфекция поддерживается аминокислотами, участвующими в связывании жёлчных кислот (а не тех, которые участвуют в связывании натрия). Взаимодействие между NTCP и HBV/HDV, по-видимому, опосредовано 75 N-концевыми аминокислотными остатками в PreS1-домене вирусных поверхностных белков и участком связывания на NTCP, расположенном на спирали 5 на внешнем слое клеточной мембраны. Поскольку HDV может реплицироваться в клетках многих типов (не только в человеческих гепатоцитах), если его геном правильно доставлен в клетку, то hNTCP-трансгенные мыши[англ.], как было недавно показано, были способны к заражению HDV[9].
Ядерный транспорт
HBV проникает в клетку путём клатрин-зависимого эндоцитоза и проходит через ранние и поздние эндосомы, причём закисление и протеазная активность на него не действуют. Для HDV доказательств этому нет, хотя было показано, что L-HDAg может выступать адаптерным белком[англ.] при взаимодействии с клатрином. Этапы ядерного транспорта рибонуклеопротеина HDV после проникновения в клетку и лишения генома оболочки изучены не до конца. Перемещение рибонуклеопротеина HDV между цитоплазмой и ядром может происходить при участии HDAg и его взаимодействии с импортинами[9]. Нуклекапсид переносится в ядро благодаря сигналу ядерной локализации, имеющемуся у дельта-антигена[25].
Репликация и синтез белка

В ходе репликации антигеномная РНК находится исключительно в ядре и синтезируется в ядрышке, в то время как молекулы геномной РНК, синтезирующиеся в нуклеоплазме, могут вступить в другой цикл репликации в ядре или экспортироваться в цитоплазму для сборки новых вирусных частиц[9][26].
HDV удваивается путём РНК-зависимой РНК-репликации по механизму двойного катящегося кольца, в котором задействованы клеточные ДНК-зависимые РНК-полимеразы, которые, по-видимому, сменяют свою специфичность (с ДНК на РНК). Механизм двойной репликации по типу катящегося кольца сходен с симметричной репликацией по типу катящегося кольца у вироидов, однако включает стадию синтеза мРНК. Он основан на двух кольцевых РНК-матрицах различной полярности (геном и антигеном) и включает образование мультимерных линейных транскриптов как промежуточных соединений[9].
Для репликации РНК HDV необходимы три ферментативные активности:
- полимеразная активность для синтеза олигомерных цепей на кольцевых матрицах, причём на первом этапе на геномной матрице синтезируется антигеномная, а на втором этапе антигеном выступает матрицей для синтеза генома;
- рибозим-зависимая РНКазная активность для разрезания этих цепей на мономеры;
- лигазная активность для замыкания мономеров в кольцо[9].
В отличие от некоторых РНК-содержащих вирусов с более крупными геномами, у HDV нет собственной РНК-зависимой РНК-полимеразы. Более того, в отличие от других вирусов-сателлитов, HDV не использует полимеразу хелперного вируса (то есть вируса, только в присутствии которого возможно образование вирионов HDV), а потому целиком полагается на ферменты клетки-хозяина. Имеется ряд доказательств того, что в репликации HDV участвует РНК-полимераза II. Во-первых, мРНК HDV имеют кэп на 5'-конце и поли(А)-хвост на 3'-конце, как и клеточные мРНК; во-вторых, транскрипция РНК HDV подавляется небольшими дозами α-аманитина — ингибитора РНК-полимеразы II; наконец, РНК-полимераза II может связываться как с геномной, так и с антигеномной РНК HDV. Имеются данные, что синтез антигеномной РНК демонстрирует некоторую устойчивость к α-аманитину, поэтому, возможно, в транскрипции участвует и РНК-полимераза I[англ.]. Показано, что и РНК-полимераза I, и РНК-полимераза III могут взаимодействовать с РНК HDV, а синтез генома и антигенома может происходить в различных зонах ядра[27][9].
Одно из различий между транскрипцией и репликацией геномной РНК этого вируса заключается в используемых ферментах. Более того, доказано, что транскрипция и репликация начинаются с разных сайтов, и, следовательно, используют различные РНК-полимеразы. Кроме того, механизм, отвечающий за репликацию генома, не распознаёт сигнал разрезания/полиаденилирования, который необходим для созревания 3'-конца мРНК. Известно, что РНК-полимераза I, которая в клетке транскрибирует гены рРНК, не взаимодействует с клеточными факторами, участвующими в разрезании и полиаденилировании транскриптов РНК-полимеразы II. Это может служить объяснением того факта, что мультимерные антигеномные РНК, получающиеся в результате репликации по типу катящегося кольца с использованием геномной РНК в качестве матрицы, не разрезаются по сигналу полиаденилирования[27].
Согласно альтернативной интерпретации экспериментальных данных, и для репликации, и для транскрипции используется РНК-полимераза II. Эта модель предполагает, что сигнал полиаденилирования распознаётся клеточными факторами разрезания не во всех случаях, что даёт возможность синтезировать как мультимерные антигеномные матрицы, так и мРНК длиной 800 нуклеотидов, при помощи одной и той же клеточной РНК-полимеразы. Однако эта модель не объясняет нечувствительности синтеза антигеномных матриц к α-аманитину[20].
Хотя конкретную роль отдельных полимераз в репликации HDV ещё предстоит установить, понятно, что HDV способен заставить работать ДНК-зависимую РНК-полимеразу с РНК. Механизмы такого переключения в значительной мере неясны. Вероятно, в переключении специфичности РНК-полимеразы II участвует S-HDAg. Он может связываться с РНК-полимеразой II и усилять транскрипцию или непосредственно стимулируя элонгацию, или нивелируя ингибиторные воздействия. Более того, он биохимически взаимодействует с 9 из 12 субъединиц РНК-полимеразы II. Возможно, это взаимодействие не ограничено одной лишь РНК-полимеразой II, поскольку S-HDAg взаимодействует и/или колокализуется с белками ядрышка (в том числе нуклеофозмином и нуклеолином), что может служить дополнительным подтверждением участия РНК-полимеразы I в репликации HDV[9]. Возможно также, что ДНК-зависимый фермент работает с геномной РНК благодаря её частично двуцепочечной палочковидной структуре[27].
мРНК HDV имеет единственную открытую рамку считывания, кодирующую дельта-антиген[5]. Наличие сайтов инициации транскрипции или промоторов на РНК HDV является предметом споров. Показано, что 5'-концевой участок мРНК HDAg совпадает с одним из концов палочковидной геномной РНК, имеет сложную вторичную структуру и может играть важную роль в репликации HDV[9].
Геномные и антигеномные молекулы образуются путём разрезания линейных поли- или олигомерных предшественников. Это разрезание осуществляет рибозим, имеющийся как в геноме, так и в антигеноме. Для замыкания мономеров в кольцо (геном или антигеном) необходима лигазная активность. В то время как некоторые исследования продемонстрировали участие в этом лигазы клетки хозяина, так как лигирование РНК HDV происходит только в клетках млекопитающих, в другой работе была показана способность последовательностей рибозима HDV к самолигированию[9].
Сборка вирионов
Для образования вириона HDV рибонуклеопротеин HDV должен быть покрыт по крайней мере S- и L-HBsAg, поэтому сборка частиц HDV возможна только в клетках, коинфицированных HBV. Относительно сборки частиц HDV и их выхода из клетки существует много вопросов, не имеющих ответа. В отличие от HBV, для высвобождения частиц которого необходим цитоплазматический домен HBsAg, включающий соединительный участок между PreS1 и PreS2, HDV в этом не нуждается. На основании этого было высказано предположение, что HDV использует преимущественно путь высвобождения субвирусных частиц через аппарат Гольджи, а не через мультивезикулярное тельце, как HBV. Возможно, в экспорте вирионов HDV участвует клатрин. Для формирования оболочки вокруг рибонуклеопротеина HDV необходимо фарнезилирование C-концевого участка L-HDAg, поскольку оно управляет взаимодействием с S-участком HBsAg. Фарнезилирование включает прикрепление цепочки из 15 атомов углерода к мотиву C211XXQ-бокс, присутствующему на C-конце L-HDAg и консервативному среди всех генотипов HDV[9].
Взаимодействие с клеточными белками
РНК HDV взаимодействует с различными белковыми факторами клетки-хозяина, чтобы максимально усилить свою инфективность. Взаимодействие может быть прямым или опосредованным через взаимодействие с ними HDAg. HDAg может подвергаться различным посттрансляционным модификациям, среди которых фосфорилирование, ацетилирование, метилирование, сумоилирование[англ.] и фарнезилирование, что позволяет ему взаимодействовать с различными белками клетки и регулировать инфективность вируса. Интересным примером может служить взаимодействие HDAg с транскрипционным фактором YY1[англ.], которое индуцирует сборку комплекса CBP/p300[англ.] (двух бромодомен-содержащих белков) и тем самым усиливает репликацию HDV[28].
На различные этапы жизненного цикла HDV может также влиять непосредственное взаимодействие РНК с белками. Глицеральдегид-3-фосфатдегидрогеназа[англ.] (GADPH) — фермент, который в норме участвует в метаболизме глюкозы. Однако его взаимодействие с геномной или антигеномной РНК HDV заставляет этот белок переместиться в ядро и усиливать рибозимную активность вируса. Похоже, что при инфекции HDV GADPH действует как молекулярный шаперон, расплетая вирусную РНК и приводя её в конформацию, содержащую двойной псевдоузел, а потому усиливая саморазрезание[28].
Другим примером непосредственного взаимодействия РНК HDV с белками клетки может служить взаимодействие все трёх РНК HDV с PKR[англ.] — киназой, активирующей различные клеточные факторы, в том числе eIF2a[англ.] — важный фактор преинициаторного комплекса трансляции, играет важную роль во врождённом иммунитете. Взаимодействие с РНК HDV активирует PKR, хотя этот белок обычно взаимодействует с двуцепочечными, но не одноцепочечными РНК. Возможно, двуцепочечных участков, содержащихся в РНК HDV, достаточно для этого взаимодействия. В таблице ниже перечислены другие клеточные белки (кроме вышеупомянутых РНК-полимераз), с которыми взаимодействует HDV[28].
| Белок | Функция в здоровой клетке | Предполагаемая функция у HDV |
|---|---|---|
| GADPH | Метаболизм глюкозы | Усиливает активность рибозима HDV |
| PKR | Трансляция | Посттрансляционные модификации |
| PSF | Процессинг пре-МРНК | Привлечение РНК HDV к РНК-полимеразе II |
| p54nrb | Процессинг пре-МРНК | ? |
| hnRNPL[англ.] | Процессинг пре-МРНК | ? |
| ASF | Сплайсинг пре-МРНК | ? |
| eEF1A1[англ.] | Трансляция | ? |
| NUMA1[англ.] | Стабилизация веретена деления | ? |
| ANKS6 | ? | ? |
| FBXL-17 | Убиквитиновый комплекс | ? |
Связь с заболеваниями
У человека HDV вызывает тяжёлое заболевание печени — гепатит D. Симптомы гепатита D такие же, как при гепатите B, однако степень их выраженности гораздо выше. Кроме того, при гепатите D гораздо более высок риск развития цирроза печени. Течение болезни может зависеть от генотипа вируса гепатита дельта: инфекция, вызванная вирусом генотипа 1, характеризуется более тяжёлым течением, чем вызванные вирусами генотипов 2 и 4. Кроме того, белки вируса гепатита дельта могут вызывать изменения протеома клеток печени, которые способствуют их злокачественному перерождению; таким образом, гепатит D может лежать в основе гепатоцеллюлярной карциномы[9][29]. Кроме того, лечение гепатита D интерфероном часто приводит к расстройствам щитовидной железы[30].
Показана возможность участия вируса гепатита дельта в развитии аутоиммунных заболеваний печени, таких как синдром Шегрена[31].
Экспериментальные модели
После открытия вируса гепатита дельта для его дальнейшего изучения использовались как модели in vitro, так и in vivo[9].
In vitro
Как указано выше, HDV в отличие от HBV может реплицироваться в клетках млекопитающих самых разных типов, если в них доставлен вирусный геном, а не только в гепатоцитах. Большинство исследований репликации вируса проводилось на моделях in vitro трансфекции клеток линии гепатоцеллюлярной карциномы (в том числе Huh7, HepG2). Однако для сборки вирусных частиц необходимы белки HBV, поэтому часто проводят ко-трансфекцию плазмидами, кодирующими поверхностные белки HBV[9].
До недавнего времени заразить HDV удавалось только лишь дифференцированные первичные человеческие гепатоциты (РНН), гепатоциты шимпанзе или тупайи, а также нетрансформированные клетки линии HepaRG. Однако работа с этими клетками была очень сложна, кроме того, были проблемы с воспроизводимостью экспериментов. Идентификация hNTCP как рецептора HDV изменила ситуацию, так как позволила заражать HDV более удобные для работы клетки[9].
In vivo
Хотя естественным хозяином вируса гепатита дельта является человек, некоторые млекопитающие тоже чувствительны к этому вирусу. HDV интенсивно изучался на шимпанзе с использованием HBV в качестве хелперного вируса, а также на сурках (в качестве хелперного вируса использовался гепаднавирус сурков). Кроме того, для изучения HDV использовали малайскую тупайю, чувствительную к HBV, шерстистых обезьян и в более недавнее время летучих мышей. К настоящему моменту разработаны разнообразные мышиные модели для изучения HDV[9].
Использование
Рибозим вируса гепатита дельта используется для создания искусственных регуляторных элементов, модулирующих экспрессию генов. Например, для регуляции экспрессии гена MAP4K4[англ.] была создана конструкция из аллостерически регулируемого рибозима HDV со встроенным теофиллиновым аптамером, которая вместе с первичной микроРНК может осуществлять сайленсинг гена MAP4K4 в клетках печени на уровне РНК посредством РНК-интерференции[32].
Примечания
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ Абдурахманов Д. Т. Хронический гепатит дельта: клинико-морфологическая характеристика, течение и исходы // Рос. ж. гастроэнтерол., гепатол., колопроктол. — 2004. — Т. 14, № 4. — С. 14—17. Архивировано 22 декабря 2015 года.
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии / Под ред. А. А. Воробьева, А. С. Быкова. — М.: Медицинское информационное агентство, 2003. — С. 131. — ISBN 5-89481-136-8.
- ↑ Human and Medical Virology, 2010, p. 122.
- ↑ 1 2 3 Acheson, 2011, p. 383.
- ↑ Fattovich G., Giustina G., Christensen E., Pantalena M., Zagni I., Realdi G., Schalm S. W. Influence of hepatitis delta virus infection on morbidity and mortality in compensated cirrhosis type B. The European Concerted Action on Viral Hepatitis (Eurohep). (англ.) // Gut. — 2000. — Vol. 46, no. 3. — P. 420—426. — PMID 10673308.
- ↑ 1 2 Flores R., Owens R. A., Taylor J. Pathogenesis by subviral agents: viroids and hepatitis delta virus. (англ.) // Current opinion in virology. — 2016. — Vol. 17. — P. 87—94. — doi:10.1016/j.coviro.2016.01.022. — PMID 26897654.
- ↑ Rizzetto M., Canese M. G., Aricò S., Crivelli O., Trepo C., Bonino F., Verme G. Immunofluorescence detection of new antigen-antibody system (delta/anti-delta) associated to hepatitis B virus in liver and in serum of HBsAg carriers. (англ.) // Gut. — 1977. — Vol. 18, no. 12. — P. 997—1003. — PMID 75123.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Alfaiate D., Dény P., Durantel D. Hepatitis delta virus: From biological and medical aspects to current and investigational therapeutic options. (англ.) // Antiviral research. — 2015. — Vol. 122. — P. 112—129. — doi:10.1016/j.antiviral.2015.08.009. — PMID 26275800.
- ↑ Human and Medical Virology, 2010, p. 124.
- ↑ Wang K. S., Choo Q. L., Weiner A. J., Ou J. H., Najarian R. C., Thayer R. M., Mullenbach G. T., Denniston K. J., Gerin J. L., Houghton M. Structure, sequence and expression of the hepatitis delta (delta) viral genome. (англ.) // Nature. — 1986. — Vol. 323, no. 6088. — P. 508—514. — doi:10.1038/323508a0. — PMID 3762705.
- ↑ Fauquet C.M., Mayo M.A., Maniloff J., Desselberger U., Ball L.A. Deltavirus (неопр.) // Eight Report of the International Committee on Taxonomy of Viruses. London. — 2005. — С. 735—738.
- ↑ New taxa ratified in 1993 : [англ.] : [арх. 22 декабря 2015] // Arch Virol. — Code: [1993.02V]. — 1993. — Vol. 133. — P. 491—495.
- ↑ Radjef N., Gordien E., Ivaniushina V., Gault E., Anaïs P., Drugan T., Trinchet J. C., Roulot D., Tamby M., Milinkovitch M. C., Dény P. Molecular phylogenetic analyses indicate a wide and ancient radiation of African hepatitis delta virus, suggesting a deltavirus genus of at least seven major clades. (англ.) // Journal of virology. — 2004. — Vol. 78, no. 5. — P. 2537—2544. — PMID 14963156.
- ↑ Fields, 2013, p. 2227.
- ↑ Lin C. C., Lee C. C., Lin S. H., Huang P. J., Li H. P., Chang Y. S., Tang P., Chao M. RNA recombination in Hepatitis delta virus: Identification of a novel naturally occurring recombinant. (англ.) // Journal of microbiology, immunology, and infection = Wei mian yu gan ran za zhi. — 2015. — doi:10.1016/j.jmii.2015.10.013. — PMID 26757847.
- ↑ Le Gal F., Gault E., Ripault M. P., Serpaggi J., Trinchet J. C., Gordien E., Dény P. Eighth major clade for hepatitis delta virus. (англ.) // Emerging infectious diseases. — 2006. — Vol. 12, no. 9. — P. 1447—1450. — doi:10.3201/eid1209.060112. — PMID 17073101.
- ↑ 1 2 3 4 Fields, 2013, p. 2223.
- ↑ Fields, 2013, p. 2226.
- ↑ 1 2 3 4 Acheson, 2011, p. 384.
- ↑ Weiner A. J., Choo Q. L., Wang K. S., Govindarajan S., Redeker A. G., Gerin J. L., Houghton M. A single antigenomic open reading frame of the hepatitis delta virus encodes the epitope(s) of both hepatitis delta antigen polypeptides p24 delta and p27 delta. (англ.) // Journal of virology. — 1988. — Vol. 62, no. 2. — P. 594—599. — PMID 2447291.
- ↑ Fields, 2013, p. 2225.
- ↑ Zuccola H. J., Rozzelle J. E., Lemon S. M., Erickson B. W., Hogle J. M. Structural basis of the oligomerization of hepatitis delta antigen. (англ.) // Structure (London, England : 1993). — 1998. — Vol. 6, no. 7. — P. 821—830. — PMID 9687364.
- ↑ Fields, 2013, p. 2224.
- ↑ Xia Y. P., Yeh C. T., Ou J. H., Lai M. M. Characterization of nuclear targeting signal of hepatitis delta antigen: nuclear transport as a protein complex. (англ.) // Journal of virology. — 1992. — Vol. 66, no. 2. — P. 914—921. — PMID 1731113.
- ↑ Li Y. J., Macnaughton T., Gao L., Lai M. M. RNA-templated replication of hepatitis delta virus: genomic and antigenomic RNAs associate with different nuclear bodies. (англ.) // Journal of virology. — 2006. — Vol. 80, no. 13. — P. 6478—6486. — doi:10.1128/JVI.02650-05. — PMID 16775335.
- ↑ 1 2 3 Acheson, 2011, p. 383—384.
- ↑ 1 2 3 Katsarou K., Rao A. L., Tsagris M., Kalantidis K. Infectious long non-coding RNAs. (англ.) // Biochimie. — 2015. — doi:10.1016/j.biochi.2015.05.005. — PMID 25986218.
- ↑ Shirvani-Dastgerdi E., Schwartz R. E., Ploss A. Hepatocarcinogenesis associated with hepatitis B, delta and C viruses. (англ.) // Current opinion in virology. — 2016. — Vol. 20. — P. 1—10. — doi:10.1016/j.coviro.2016.07.009. — PMID 27504999.
- ↑ Suvak B., Dulger A. C., Aykaç M. C., Gonullu H., Gonullu E. Delta hepatitis-related thyroid disease: a unique phenomenon. (англ.) // Przeglad gastroenterologiczny. — 2015. — Vol. 10, no. 3. — P. 169—172. — doi:10.5114/pg.2015.49687. — PMID 26516384.
- ↑ Weller M. L., Gardener M. R., Bogus Z. C., Smith M. A., Astorri E., Michael D. G., Michael D. A., Zheng C., Burbelo P. D., Lai Z., Wilson P. A., Swaim W., Handelman B., Afione S. A., Bombardieri M., Chiorini J. A. Hepatitis Delta Virus Detected in Salivary Glands of Sjögren's Syndrome Patients and Recapitulates a Sjögren's Syndrome-Like Phenotype in Vivo. (англ.) // Pathogens & immunity. — 2016. — Vol. 1, no. 1. — P. 12—40. — PMID 27294212.
- ↑ Cheng H., Zhang Y., Wang H., Sun N., Liu M., Chen H., Pei R. Regulation of MAP4K4 gene expression by RNA interference through an engineered theophylline-dependent hepatitis delta virus ribozyme switch. (англ.) // Molecular bioSystems. — 2016. — Vol. 12, no. 11. — P. 3370—3376. — doi:10.1039/c6mb00540c. — PMID 27754501.
Литература
- Fields Virology / Editors-in-chief David M. Knipe, Peter M. Howley. — Sixth edition. — Philadelphia, USA: Lippincott Williams & Wilkins, 2013. — 2582 p. — ISBN 978-1-4511-0563-6.
- Nicholas H. Acheson. Fundamentals of Molecular Virology. — 2nd edition.. — WILEY (John Wiley & Sons, Inc.), 2011. — P. 379—383. — 528 p. — ISBN 978-0-470-90059-8.
- Desk Encyclopedia of Human and Medical Virology / Editors-in-chief Brian W. J. Mahy, Marc H. V. van Regenmortel. — Elsevier Ltd., 2010. — 661 p. — ISBN 978-0-12-375147-8.