Внутриклеточная сортировка белков
Внутриклеточная сортировка белков (англ. protein sorting, protein targeting) — процессы мечения и последующего транспорта белков в живых клетках, которые приводят к попаданию белков в определённые компартменты клетки.
Синтезируемые в цитоплазме на рибосомах белки должны попадать в разные компартменты клетки — ядро, митохондрии, эндоплазматический ретикулум (ЭПР), аппарат Гольджи, лизосомы и другие[], а некоторые белки должны попасть на наружную мембрану или во внеклеточную среду. Для попадания в определённый компартмент белок должен обладать специфической меткой. В большинстве случаев такой меткой является часть аминокислотной последовательности самого белка (лидерный пептид, или сигнальная последовательность белка). В некоторых случаях меткой служат посттрансляционно присоединённые к белку олигосахариды.
Транспорт белков в ЭПР
Котрансляционный транспорт в ЭПР
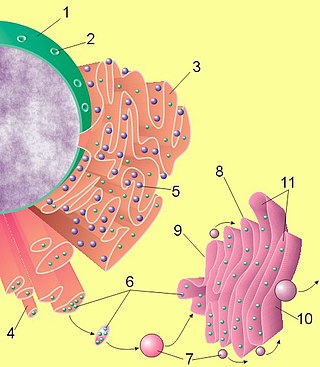
Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР. Сигнальная последовательность для ЭПР включает обычно 5-10 преимущественно гидрофобных аминокислот и расположена на N-конце белка. В её удаленном от конца части имеется консенсусная последовательность, узнаваемая специфической протеазой. Эта сигнальная последовательность опознаётся специальным комплексом — «опознающей сигнал частицей» (signal-recognition particle, SRP). В состав SRP входит шесть белков и короткая молекула 7SL РНК [1]. Один участок SRP связывает сигнальную последовательность, а другой связывается с рибосомой и блокирует трансляцию. Отдельный домен SRP отвечает за связывание с SRP-рецептором на мембране ЭПР.
Вместе с SRP рибосома перемещается к ЭПР и связывается с рецептором SRP (интегральным белком) на цитозольной стороне мембраны ЭПР. Этот комплекс (рибосома — SRP — рецептор SRP) связывается с порой — транслокатором белка на мембране ЭПР. Обычно с мРНК связаны несколько рибосом, и на мембране ЭПР сидят полирибосомы, причем каждая рибосома присоединена к своей поре. Дойдя до 3'-конца мРНК, рибосома возвращается в цитоплазму, однако мРНК удерживается у мембраны ЭПР за счет того, что новые рибосомы, вязанные с SRP, присоединяются к её 5'-концу.
После связывания с транслокатором комплекс SRP — рецептор SRP отделяется от рибосомы, и это приводит к возобновлению трансляции. Сейчас доказано, что белок по мере трансляции проникает в ЭПР через водный канал транслокатора, имеющий воротный механизм и сформированный у эукариот четырьмя субъединицами комплекса Sec61 (гомологичные белки есть и на мембранах бактериальных клеток).
После возобновления трансляции гидрофобный участок сигнальной последовательности остается связан с транслокатором, а вновь синтезируемый белок в виде петли проталкивается внутрь ЭПР. Этот процесс не требует дополнительных затрат энергии АТФ. После того, как С-конец белка отделяется от рибосомы и оказывается внутри ЭПР, протеаза сигнального пептида отрезает его от белка. Белок внутри ЭПР сворачивается, приобретая нормальную конформацию, а сигнальный пептид через открывшийся в транслокаторе боковой канал перемещается в липидный бислой мембраны ЭПР, где быстро разрушается протеазами.
Попавший в ЭПР белок остается в этой органелле, если имеет специальную «удерживающую в ЭПР» (ER-retaining) последовательность из четырех аминокислот на С-конце. Некоторые из остающихся в ЭПР белков играют важную роль в сворачивании и посттрансляционной модификации проходящих через ЭПР белков. Так, фермент дисульфид-изомераза катализирует окисление свободных SH-групп цистеина и образование дисульфидных связей, а белок-шаперон BiP препятствует неправильному сворачиванию и агрегации белков до образования ими четвертичных структур, а также способствует удержанию связанных с ним белков в ЭПР.
Встраивание белков в мембраны ЭПР
Похожий, но более сложный механизм обеспечивает котрансляционное встраивание трансмембранных белков в мембрану ЭПР.
Посттрансляционный транспорт в ЭПР
Существует также посттрансляционный транспорт белков в ЭПР (более обычный у дрожжей), при котором полностью синтезированный белок связывается в цитозоле с шаперонами, а затем переносится в ЭПР через транслокатор при участии шаперонов семейства Hsp70. Этот вид транспорта является АТФ-зависимым. Для транспорта пептидов (длиной преимущественно в 8-16 аминокислот) из цитозоля в ЭПР для последующей их презентации в комплексе с молекулами MHC-I существует специальный транслокатор — TAP-белок.
Транспорт белков в аппарат Гольджи, лизосомы, на наружную мембрану и во внеклеточную среду
Гликозилирование и сворачивание белков в ЭПР. Ретранслокация белков в цитоплазму из ЭПР
Из ЭПР в аппарат Гольджи (АГ), а оттуда в лизосомы, на внешнюю мембрану или во внеклеточную среду белки попадают путём везикулярного транспорта. Большинство белков, попавших в полость ЭПР, гликозилируются с помощью стандартного олигосахарида, синтез которого осуществляется на мембранах шероховатого ЭПР. Синтезированный олигосахарид связан пирофосфатной связью с липидом долихолом, который заякоривает его в мембране, и переносится на боковую аминогруппу аспарагина с помощью фермента олигосахарил-трансферазы. От наличия этой олигосахаридной метки зависит правильное сворачивание белков, так как к ней (после её модификации) присоединяются кальций-зависимые шапероны калнексин и калретикулин (которые одновременно являются лектинами); они удерживают не полностью свернутые белки в ЭПР и обеспечивают их взаимодействие с другими шаперонами. Если за некоторое время белок не свернулся правильно, то он ретранслоцируется обратно в цитозоль, лишается олигосахарида, убиквитинилируется и деградирует в протеасомах. Если же белок свернулся правильно, то он может переместиться в АГ или остаться в ЭПР.
Транспорт белков из ЭПР в АГ
Белки поступают из ЭПР в АГ внутри окаймленных мембранных пузырьков, оболочка которых образуется из белка COP-II. Все правильно свернутые белки попадают в такие пузырьки «по умолчанию» и перемещаются в АГ, а затем некоторые из них возвращаются в ЭПР. Однако белки со специальными сигнальными метками концентрируются в транспортных пузырьках, а белки без таких меток попадают туда в небольшом количестве. Отделившиеся от ЭПР пузырьки, лишившись оболочек, сливаются в трубчато-везикулярные кластеры, которые с помощью моторных белков перемещаются по микротрубочкам к АГ. От этих кластеров (как и от цис-Гольджи) отделяются пузырьки, одетые белком COP-I, обеспечивающие обратный транспорт резидентных белков в ЭПР. Возврат белков в ЭПР обеспечивается короткой сигнальной последовательностью на их С-конце, которая связывается либо непосредственно с COP-I (для мембранных белков), либо со специфическим рецептором, взаимодействующим с COP-I (для растворимых белков). Лишенные этих последовательностей белки преимущественно остаются в АГ.
Внутри пузырьков белки постепенно перемещаются из цис-Гольджи в транс-Гольджи. По мере перемещения белков анутри АГ ферменты гликозилтрансферазы осуществляют модификацию их олигосахаридных «меток». С помощью подобных ферментов в АГ происходит синтез гликопротеидов — муцинов и протеогликанов.
Транспорт белков в лизосомы
Транспорт белков из АГ в лизосомы
Мембранные белки и пищеварительные ферменты лизосом поступают из транс-Гольджи в составе окаймленных клатрином пузырьков в раннюю эндосому, а оттуда — в лизосомы. Для попадания лизосомальных ферментов (кислых гидролаз) в лизосомы на них должна присутствовать специальная метка — остатки маннозо-6-фосфата на концах олигосахаридных цепей. Эта метка наносится в два этапа. Сперва в цис-Гольджи фермент N-ацетилглюкозаминфосфотрансфераза присоединяет к олигосахаридам остатки N-ацетилглюкозаминфосфата, а затем в транс-Гольджи второй фермент отщепляет N-ацетилглюкозамин. Метка наносится на те белки, которые имеют специфические черты третичной структуры — «сигнальный бугорок» (signal patch). Затем маннозо-6-фосфаты опознаются специфическим мембранным рецептором, к которому присоединяются гидролазы. В эндосомах при понижении рН гидролазы отделяются от рецепторов, которые в составе специальных пузырьков доставляются обратно в АГ.
Мутации гена N-ацетилглюкозаминфосфотрансферазы приводят к развитию тяжелой формы мукополисахаридоза — I-клеточной болезни, при которой все ферменты лизосом секретируются во внеклеточную среду.
Транспорт белков из внешней среды в лизосомы
Даже в норме часть лизосомальных ферментов выделяется из клетки, а часть мембранных белков лизосом попадает на её наружную мембрану. Из внеклеточной среды лизосомальные ферменты могут поглощаться путём эндоцитоза и доставляться в лизосомы (см.[2]).
Транспорт белков из цитоплазмы в лизосомы
Кроме везикулярного транспорта из АГ, существует и другой путь транспорта белков в лизосомы. Так, при шаперон-опосредованной аутофагии происходит направленный транспорт частично денатурировавших белков из цитоплазмы сквозь мембрану лизосомы в её полость, где они перевариваются. Этот тип аутофагии, описанный только для млекопитающих, индуцируется стрессом. Она происходит при участии цитоплазматических белков-шаперонов семейства hsр-70, вспомогательных белков и LAMP-2, который служит мембранным рецептором комплекса шаперона и белка, подлежащего транспорту в лизосому. В антиген-презентирующих клетках (например, в дендритных клетках) транспорт пептидов, презентируемых в комплексе с MHC-II, может происходить прямо в лизосомы с помощью белка-транслокатора TAPL.
Транспорт белков в клеточное ядро и из ядра
В ядро белки попадают через ядерные поры. Через ядерную пору может одновременно транспортироваться до 500 макромолекул в обоих направлениях. Белки (пептиды) с молекулярной массой до 5000 дальтон свободно диффундируют через ядерные поры. Путём пассивного транспорта (диффузии) через поры могут проникать белки с молекулярной массой до 60 000 дальтон.
Более крупные белки транспортируются в ядро активно (с затратой энергии). Для перемещения в ядро такие белки должны содержать определённую аминокислотную последовательность — сигнал ядерной локализации. С этой последовательностью напрямую или с помощью адаптерных белков связываются транспортные факторы — кариоферины (импортины). Кариоферины связываются также с компонентами ядерных пор. Энергию для транспорта обеспечивает гидролиз ГТФ, осуществляемый малой мономерной ГТФ-азой Ran. В цитоплазме Ran находится в связанном с ГДФ виде, так как в цитоплазме локализованы белки Ran-GAP (белки-активаторы ГТФ-азной активности Ran), а в ядре Ran находится в связанном с ГТФ виде, поскольку в ядре локализован белок, обеспечивающий обмен ГДФ на ГТФ. Ran-ГТФ, связываясь на внутренней стороне ядерной поры с «нагруженным» кариоферином, обеспечивает его разгрузку. Затем рецептор с присоединённым Ran-ГТФ выходит в цитоплазму, где GAP-белок вызывает гидролиз ГТФ и отделение Ran-ГДФ от кариоферина.
Аналогичный механизм обеспечивает экспорт белков из ядра, только эти белки должны обладать иной сигнальной последовательностью — сигналом экспорта из ядра, с которой связываются экспортины.
Транспорт белков в митохондрии и пластиды
В митохондрии и хлоропласты белки, обладающие соответствующими сигнальными последовательностями, попадают через специфические белковые поры-транслокаторы при участии шаперонов.