Восстановительный цикл трикарбоновых кислот
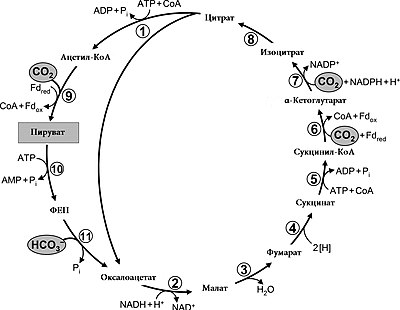
Обра́тный цикл Кре́бса, также известный как обра́тный цикл трикарбо́новых кисло́т, или цикл А́рнона — последовательность химических реакций, которую некоторые бактерии используют для синтеза органических соединений из диоксида углерода и воды.
Фактически это обращённый цикл трикарбоновых кислот (ЦТК, цикл Кребса): там, где в цикле Кребса органические вещества в форме сахаров окисляются до CO2 и воды, обратный цикл использует CO2 и воду для синтеза новых соединений. Цикл используется анаэробными зелёными серобактериями и аэробами рода Hydrogenobacter для синтеза органических веществ, а водород, сульфид или тиосульфат выступают в качестве донора электронов[1][2]. Цикл также был обнаружен у археи Pyrobaculum islandicum[3]. Примечательно, что у одного и того же вида было показано наличие как восстановительного, так и окислительного ЦТК: Thermoproteus tenax, Desulfobacter hydrogenophilus[англ.] и Pyrobaculum islandicum[4][5][6].
Поступали сообщения, что цикл может присутствовать у эукариотического организма Chlamydomonas reinhardtii, однако анализ генома не подтвердил его наличие. В настоящий момент нет достоверных сведений о наличии цикла Арнона у эукариотических организмов[3].
Этот цикл был открыт в 1966 году учёными Эвансом, Бью́кененом и Арноном (англ. Evans, Buchanan and Arnon)[1].
Ферменты

Считается, что три реакции цикла Кребса необратимы, а значит, в цикле Арнона эти реакции должны осуществляться другими ферментами, чтобы сделать цикл обратимым: так, сукцинатдегидрогеназа заменена на фумаратредуктазу, НАД+-зависимая α-кетоглутаратдегидрогеназа на ферредоксин-зависимую α-кетоглутаратсинтазу, а цитратсинтаза на АТФ-цитратлиазу. Эти три фермента обычно считаются характерными для данного цикла[6].
Большинство бактерий, которые используют этот цикл — мезофилы, однако представители филума Aquificae растут при температуре 70 °C и выше (Aquifex aeolicus вплоть до 95 °C). При таких условия термически неустойчивый сукцинил-CoA[англ.] постепенно гидролизуется до сукцината и коэнзима А, что сопровождается потерей энергии и делает невозможным его дальнейшее использование в цикле. Aquificae (как было показано на Hydrogenobacter thermophilus[англ.][6]) решают эту проблему, тратя дополнительный АТФ на превращение α-кетоглутарата в изоцитрат совместным действием биотин-зависимой α-кетоглутараткарбоксилазы и недекарбоксилирующей изоцитратдегидрогеназы, что делает процесс необратимым при повышенной температуре[6].
У некоторых видов основной путь цикла может иметь некоторые отличия. Так вместо АТФ-цитратлиазы расщепление цитрата могут осуществлять два других фермента: цитрил-CoA синтаза и цитрил-CoA лиаза[англ.]. Однако, оба эти фермента филогенетически близки к АТФ-цитратлиазе. Их обнаружили у представителей Aquificaceae (но не у других Aquificae). Более того, некоторые протеобактерии (например, Magnetococcus sp. штамм MC-1), вероятно, обладают новым типом АТФ-цитратлиазы[6].
Химизм
На конечном этапе цикла ключевой фермент цикла АТФ-цитратлиаза разрушает цитрат на оксалоацетат и ацетил-CoA, используя энергию одной АТФ. Далее происходят следующие реакции[7]:
- Ацетил~CoA + CO2 + ФдH2 → Пируват + Фд
- Пируват + АТФ → ФЕП + АДФ + Фн
- ФЕП + АТФ + 2H+ → глицеральдегид-3-фосфат + АМФ + ФФн
Полученный глицеральдегид-3-фосфат используется для синтеза материалов клетки. Общее уравнение ассимиляции имеет вид:
- 3CO2 + 2ФдH2 + 2НАДФН·H+ + ФАДH2 + НАДН·Н+ + 5АТФ→ глицеральдегид-3-фосфат
Ассимиляция углекислого газа идёт с большой затратой АТФ и восстановительных эквивалентов. В целом цикл считается анаэробным, поскольку включает много ферментов и восстановителей (Fe4S4 бактериальных ферредоксинов), которые чувствительны к кислороду (из аэробных бактерий такой цикл обнаружен только у Hydrogenobacter)[7].
Этот цикл является возможным кандидатом в реакции, которые могли протекать на Земле в добиологических условиях, и, по этой причине, изучение этого цикла представляет интерес для понимания происхождения жизни. Принципиально, что данный цикл является автокаталитическим — в нём, в отличие от окислительного ЦТК в результате одного оборота цикла количество реагентов, в том числе акцепторов СО2, увеличивается, а не уменьшается, как в цикле Кребса. Так же, было доказано, что некоторые из реакций можно катализировать, используя обычные минералы, в частности пять реакций протекает в присутствии ZnS (сфалерит) на свету[8].
См. также
Примечания
- ↑ 1 2 Evans M. C., Buchanan B. B., Arnon D. I. A new ferredoxin-dependent carbon reduction cycle in a photosynthetic bacterium. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1966. — Vol. 55, no. 4. — P. 928—934. — PMID 5219700.
- ↑ Buchanan B. B., Arnon D. I. A reverse KREBS cycle in photosynthesis: consensus at last. (англ.) // Photosynthesis research. — 1990. — Vol. 24. — P. 47—53. — PMID 11540925.
- ↑ 1 2 Julian J. Eaton-Rye, Baishnab C Tripathy, Thomas D. Sharkey. Photosynthesis: Plastid Biology, Energy Conversion and Carbon Assimilation.. — 2012. — P. 654. — 856 p. Архивировано 27 сентября 2014 года.
- ↑ Siebers B., Tjaden B., Michalke K., Dörr C., Ahmed H., Zaparty M., Gordon P., Sensen C. W., Zibat A., Klenk H. P., Schuster S. C., Hensel R. Reconstruction of the central carbohydrate metabolism of Thermoproteus tenax by use of genomic and biochemical data. (англ.) // Journal of bacteriology. — 2004. — Vol. 186, no. 7. — P. 2179—2194. — PMID 15028704.
- ↑ Hu Y., Holden J. F. Citric acid cycle in the hyperthermophilic archaeon Pyrobaculum islandicum grown autotrophically, heterotrophically, and mixotrophically with acetate. (англ.) // Journal of bacteriology. — 2006. — Vol. 188, no. 12. — P. 4350—4355. — doi:10.1128/JB.00138-06. — PMID 16740941.
- ↑ 1 2 3 4 5 Berg I. A. Ecological aspects of the distribution of different autotrophic CO2 fixation pathways. (англ.) // Applied and environmental microbiology. — 2011. — Vol. 77, no. 6. — P. 1925—1936. — doi:10.1128/AEM.02473-10. — PMID 21216907.
- ↑ 1 2 Нетрусов, Котова, 2012, с. 202.
- ↑ Zhang X. V., Martin S. T. Driving parts of Krebs cycle in reverse through mineral photochemistry. (англ.) // Journal of the American Chemical Society. — 2006. — Vol. 128, no. 50. — P. 16032—16033. — doi:10.1021/ja066103k. — PMID 17165745.
Литература
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп.. — М.: Издательский центр «Академия», 2012. — С. 202. — 384 с. — ISBN 978-5-7695-7979-0.