Гидроксид-ион
Гидроксид-ион | |
|---|---|
 | |
Общие | |
| Хим. формула | HO⁻ |
Классификация | |
| Номер CAS | 14280-30-9 |
| PubChem | 961 |
| ChemSpider | 936 |
| ChEBI | 16234 |
| DrugBank | DBDB14522 |
[OH-] | |
InChI | |
InChI=1S/H2O/h1H2/p-1 | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
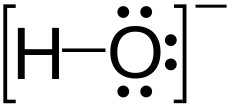
Гидроксид-ион (гидроксид-анион, гидроксильный ион) — отрицательно заряженный ион гидроксида OH−.
Гидроксид-ион изолированно существует в газовой фазе, находится в кристаллической решётке гидроксидов и основных солей, образуется в водных растворах в результате электролитической диссоциации воды или/и растворённых гидроксидов.
Наличие в водном растворе иона OH− в концентрациях, превышающих 10−7 моль/литр приводит к щелочной реакции раствора.
В реакциях комплексообразования гидроксид-ион может выступать в роли лиганда[1].
Рыхлая слоистая кристаллическая структура гидроксидов является следствием высокой поляризуемости и большого ионного радиуса гидроксид-аниона.
Ионные равновесия в газовой фазе
В газовой фазе имеет место равновесная реакция, характеризующая термическую устойчивость гидроксид-иона
Зависимость константы равновесия (Kp) от абсолютной температуры (T)[2]:
| Т,к | 1000 | 2000 | 3000 | 4000 | 5000 | 6000 |
|---|---|---|---|---|---|---|
| Кр | 1,66 · 10−7 | 2,34 · 10−2 | 1,94 | 2,23 · 10 | 1,11 · 102 | 3,56 · 102 |
Электролитическая диссоциация оснований
При электролитической диссоциации оснований образуются катионы металла и общие для всех оснований ионы гидроксида:
Таким образом, основания можно определить как химические соединения, дающие в водном растворе гидроксид-ионы.
Электролитическая диссоциация оснований характеризуется константой диссоциации в водных растворах КB[3]:
| Основание | LiOH | NaOH | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 | NH4OH |
|---|---|---|---|---|---|---|
| КB, при 25 °C | 6,75 · 10−1 | 5,9 | 4,3 · 10−2 | 1,5 · 10−1 | 2,3 · 10−1 | 1,79 · 10−5 |
Химические свойства гидроксид-иона
Основной реакцией, в которой принимает участие гидроксид-ион, является реакция нейтрализации кислот и оснований:
или в ионном виде:
Последнее выражение представляет собой общее уравнение реакций нейтрализации и показывает, что во всех случаях, когда ионы H+ встречаются с ионами гидроксида OH-, они соединяются в почти недиссоциированные молекулы воды. В реакции гидроксид-ион проявляет свойства нуклеофила — электроизбыточного химического реагента, способного взаимодействовать с электрофилами (электронодефицитными соединениями) по донорно-акцепторному механизму, приводящему к образованию ковалентной химической связи.
Гидроксид-ион принимает участие в реакциях бимолекулярного нуклеофильного замещения. Например, атом кислорода гидроксид-иона донирует пару электронов на связывание с атомом углерода в молекуле бромэтана:
Типичные реакции нуклеофильного замещения:
- Образование спиртов из галогенуглеводородов:
- Образование кетонов:
- Образование карбоновых кислот:
- Омыление сложных эфиров:
Примечания
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Константы неорганических веществ: справочник. — М.: Дрофа, 2006. — С. 595-596.
- ↑ Справочник химика. — 2-е изд., перераб. и доп.. — М.—Л.: «Химия», 1964. — Т. 3. — С. 75. — 1008 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп.. — М.—Л.: «Химия», 1964. — Т. 3. — С. 81. — 1008 с.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
















