Гидроксид кобальта(II)
| Гидроксид кобальта(II) | |
|---|---|
| Общие | |
| Систематическое наименование | Гидроксид кобальта(II) |
| Традиционные названия | Гидроокись кобальта |
| Хим. формула | Co(OH)2 |
| Физические свойства | |
| Состояние | фиолетовые кристаллы |
| Молярная масса | 92,95 г/моль |
| Плотность | 3,597 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | около 160 ± 1 °C[1] |
| Классификация | |
| Рег. номер CAS | 21041-93-0 |
| PubChem | 62748, 6093389 и 448187 |
| Рег. номер EINECS | 244-166-4 |
| SMILES | |
| InChI | |
| ChemSpider | 56492 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидроксид кобальта(II) — неорганическое соединение, гидроксид металла кобальта с формулой Co(OH)2, в зависимости от способа получения имеет окраску розовую или синюю[2], не растворяется в воде, образует гидраты.
Получение
- Действие разбавленных щелочей на раствор солей двухвалентного кобальта:
Физические свойства
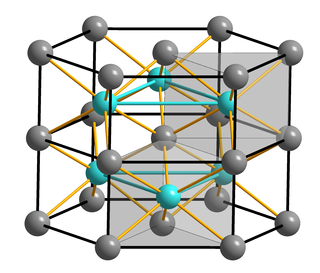
Свежеосаждённый гидроксид кобальта(II) образует синий или розовый осадок (α-форма) и является гидратом 3Co(OH)2•2H2O. α-Форма метастабильна и при стоянии переходит в стабильную β-форму — фиолетовые кристаллы, гексагональная сингония, пространственная группа P 3m1, параметры ячейки a = 0,3173 нм, c = 0,4640 нм, Z = 1.
Не растворим в воде, р ПР = 14,80.
- Варианты окраски гидроксида кобальта(II)
 Гидроксид кобальта(II) (розовый) и основные хлориды кобальта(II) (зеленый и голубой). При добавлении избытка щелочи основные соли полностью переходят в розовый гидроксид кобальта(II)
Гидроксид кобальта(II) (розовый) и основные хлориды кобальта(II) (зеленый и голубой). При добавлении избытка щелочи основные соли полностью переходят в розовый гидроксид кобальта(II)
Химические свойства
- При нагревании в вакууме разлагается:
- Реагирует с кислотами:
- Медленно реагирует с щелочами:
- Из воздуха медленно поглощает углекислый газ:
- Окисляется кислородом под давлением:
- Окисляется перекисью водорода при комнатной температуре:
См. также
Примечания
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 4—60. — ISBN 978-1-4822-0868-9
- ↑ Г. Брауэр, О. Глемзер, Г. -Л. Грубе, К. Густав и др. Руководство по неорганическому синтезу в 6-ти томах. Том 5. Стр. 1768-1769. / редактор Г. Брауэр. — Москва: "Мир", 1985. — С. 360.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.








![{\displaystyle {\mathsf {Co(OH)_{2}+2NaOH\ {\xrightarrow {\tau }}\ Na_{2}[Co(OH)_{4}]\downarrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/215d44434d03af4ba556524ff2ce0246ef6fd867)