Гидроксид лития
| Гидроксид лития | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование | Гидроксид лития |
| Хим. формула | LiOH |
| Рац. формула | LiOH |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 23,94637 г/моль |
| Плотность | 1,46 (25 °C) |
| Термические свойства | |
| Температура | |
| • плавления | 462[1] |
| • кипения | 925[1] °C |
| • разложения | 930[1] |
| Энтальпия | |
| • образования | -487,2[1] кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 12,24 г/100 мл (25 °C)[1] |
| Структура | |
| Дипольный момент | 1,6E−29 Кл·м[2] |
| Классификация | |
| Рег. номер CAS | 1310-65-2 |
| PubChem | 3939 |
| Рег. номер EINECS | 215-183-4 |
| SMILES | |
| InChI | |
| RTECS | OJ6307070 |
| ChEBI | 33979 |
| Номер ООН | 2680 |
| ChemSpider | 3802 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
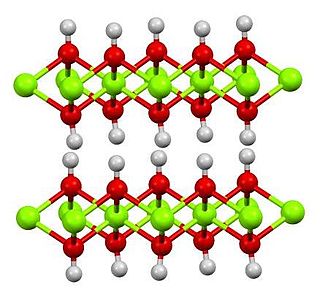
Гидроксид лития — неорганическое основание щелочного металла лития, имеющее формулу LiOH. Является сильным основанием, но наиболее слабым основанием среди щелочных металлов.
Физические свойства
Гидроксид лития при стандартных условиях представляет собой бесцветные кристаллы с тетрагональной решёткой.[1] При работе с ним необходимо проявлять осторожность, избегать попадания на кожу и слизистые оболочки, обязательно требуются защитные очки.
Растворяется в воде, 12,24 г/100 мл при 25 °C, растворимость с температурой практически не повышается. В этаноле, в отличие от гидроксида натрия, почти не растворяется.[3]
Получение
- Взаимодействие оксида лития с водой:
- Взаимодействие карбоната лития с гидроксидом кальция:
- Обменными реакциями:
Химические свойства
- Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
- Взаимодействие с кислотными оксидами с образованием соли и воды:
- При нагревании в инертной атмосфере (Ar) разлагается (диссоциация) :
- Находясь в растворе, взаимодействует с хлором. Образуемый продукт зависит от температуры раствора[4]:
Применение
Гидроксид лития используют для получения солей лития; как компонент электролитов в щелочных аккумуляторах и поглотитель углекислого газа в противогазах, подводных лодках и космических кораблях. Он также используется как катализатор полимеризации. Применяется в стекольной и керамической промышленности. При производстве водоупорных смазочных материалов - литиевых смазок (содержащих стеарат лития - литиевое мыло), обладающих механической стабильностью в широком диапазоне температур.
Примечания
- ↑ 1 2 3 4 5 6 Рабинович В. А., Хавин З. Я. Краткий химический справочник / под общей редакцией канд. хим. наук В. А. Рабиновича. — Изд. 2-е, испр. и доп. — Л : Химия, 1978. — С. 76. — 392 с. — УДК 54(031)(G).
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Гороновский И. Т., Назаренко Ю. П., Некряч Е. В. Краткий справочник по химии. Киев, Наукова думка, 1987 год.
- ↑ Лидин, 2000, с. 14.
Литература
- Химические свойства неорганических веществ / под ред. Р.А. Лидина. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.