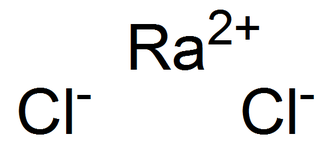Гидроксид радия
| Гидроксид радия | |
|---|---|
| Общие | |
| Систематическое наименование | Гидроксид радия |
| Традиционные названия | Гидроокись радия, едкий радит; едкий радий |
| Хим. формула | Ra(OH)2 |
| Рац. формула | Ra(OH)2 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 260,01 г/моль |
| Термические свойства | |
| Мол. теплоёмк. | 102,7 Дж/(моль·К) |
| Энтальпия | |
| • образования | -926,8 кДж/моль |
| Классификация | |
| Рег. номер CAS | 98966-86-0 |
| Безопасность | |
| Токсичность | Чрезвычайно токсичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидроксид радия — неорганическое соединение, гидроксид металла радия с формулой Ra(OH)2, бесцветные кристаллы, растворимые в воде. Является щелочью.
Получение
- Действие воды на металлический радий:
Физические свойства
Гидроксид радия образует бесцветные кристаллы, которые растворяются в воде лучше гидроксида бария, и обладает более основными свойствами.
Образует кристаллогидрат состава Ra(OH)2•8H2O[1].
Химические свойства
Гидроксид радия обладает высокими коррозионными свойствами. В частности, он способен разрушать стекло своими водными растворами при комнатной температуре подобно гидроксиду цезия[2].
Биологические свойства
Гидрооксид радия Ra(OH)2 — едкое, токсичное, и коррозионно-активное вещество. Значительно более ядовит, чем его аналоги гидроксид бария Ba(OH)2 и гидроксид стронция Sr(OH)2.
Примечания
- ↑ George K. Schweitzer,Lester L. Pesterfield. The Aqueous Chemistry of the Elements. — Oxford University Press, 2009. — 448 с.
- ↑ Золотой фонд. Школьная энциклопедия. Химия. Москва, Дрофа, 2003 г. 476 с.
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Richard C. Ropp,. Encyclopedia of the Alkaline Earth Compounds. — Elsevier, 2013. — 1187 с. — ISBN 978-0-444-59550-8.