Гидрохинон
| Гидрохинон | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование | бензол-1,4-диол | ||
| Хим. формула | C6H6O2 | ||
| Физические свойства | |||
| Молярная масса | 110,11 г/моль | ||
| Плотность | 1.36 г/см³ | ||
| Энергия ионизации | 7,95 ± 0,01 эВ[1][2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 173,8—174,8 °C | ||
| • кипения | 286,5 °C | ||
| • вспышки | 165 °C | ||
| Давление пара | 1,0E−5 ± 1,0E−5 мм рт.ст.[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 5,26 г/100 мл (5 °С) 21,21 г/100 мл (50 °С) 56,25 г/100 мл (70 °С) | ||
| • в спирте | 127,27 г/100 г | ||
| • в ацетоне | 77,94 г/100 г | ||
| Классификация | |||
| Рег. номер CAS | 123-31-9 | ||
| PubChem | 785 | ||
| Рег. номер EINECS | 204-617-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | MX3500000 | ||
| ChEBI | 17594 | ||
| ChemSpider | 764 | ||
| Безопасность | |||
| ЛД50 | 302 мг/кг (крысы, перорально) | ||
| Пиктограммы СГС | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
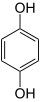
Гидрохино́н (пара-дигидроксибензол, бензол-1,4-диол, хинол) — ароматическое органическое соединение, представитель двуатомных фенолов с химической формулой C6H4(OH)2, изомер пирокатехина и резорцина. Название «гидрохинон» дано соединению Ф. Вёлером из-за схожести свойств с хиноном, из которого Вёлер его синтезировал. Сильный восстановитель, используется как проявитель в фотографии, антиоксидант в химической промышленности, реагент для определения ниобия, вольфрама, золота и цезия в аналитической химии.
Торговое наименование: H-142[3].
История
 |  | |||||||||
Ж. Б. Каванту (слева) и П. Ж. Пеллетье (справа), впервые получившие гидрохинон | ||||||||||
Впервые был выделен французскими химиками Пьером Жозефом Пеллетье и Жозефом Бьенеме Каванту при перегонке хинной кислоты в 1820 году. Синтез гидрохинона первым осуществил Фридрих Вёлер в 1844 году восстановлением хинона. Также Вёлер дал ему современное название и описал его свойства[4].
Уильям Эбней в 1880 году обнаружил проявляющие свойства соединения, что привело к разработке способов промышленного синтеза. Дальнейшие опыты с гидрохиноном привели к созданию проявителей с двумя проявляющими веществами. Первый из таких проявителей получил Генри Дж. Ньютон в 1889 году, добавив гидрохинон к эйконогеновому проявителю, и получив итоговый состав, который использовал лучшие свойства обоих проявляющих веществ. Вскоре после этого были предложены метол-гидрохиноновые проявители (обозначающиеся символами MQ в англоязычных источниках), в которых был замечен феномен супераддитивности — эффект, когда проявитель с двумя разными проявляющими веществами работает значительно более активно, чем это должно было быть, если исходить из расчета суммы активности обоих проявляющих веществ. Эффект супераддитивности был подтвержден и обоснован научными работами Левенсона в конце 1940-х годов, который показал, что в таком случае проявление изображения ведется метолом, а роль гидрохинона заключается в регенерации отработанного метола[5][4].
Открытие Дж. Д. Кендаллом проявляющей способности фенидона в 1940 году привело к созданию еще более эффективной системы фенидон-гидрохиноновых проявителей (PQ в англоязычной литературе). Фенидон мало пригоден для использования в качестве единственного проявляющего вещества, так как дает сильное вуалирование фотоматериала, но в супераддитивных проявителях с гидрохиноном эта особенность исчезает, давая качественное итоговое изображение, значительное ускорение процесса обработки, меньшую токсичность и другие преимущества по сравнению с метол-гидрохиноновыми составами[6][7].
Физические свойства
Белые или бесцветные призматические кристаллы, сладковатые на вкус[8][9]. Имеет модификации, отличающиеся физическими свойствами: стабильная α-модификация имеет температуру плавления 173,8—174,8 °C и плотность 1,36 г/см3, нестабильная γ-модификация — температуру плавления 169 °C и плотность 1,325 г/см3. Имеет молярную массу 110,11 г/моль, температуру кипения 286,5 °C, температуру вспышки 165 °C. Возгоняется при 163,5 °C (10 мм рт. ст.)[9].
Растворим в воде (5,26 г/100 мл при 5 °С, 21,21 г/100 мл при 50 °С, 56,25 г/100 мл при 70 °С), спирте (127,27 г/100 г), ацетоне (77,94 г/100 г). Образует клатраты. В частности, клатрат с метанолом имеет формулу 3C6H6O2·CH3OH[9].
Реактив может содержать примеси, выглядящие как нерастворимый чёрный порошок. Количество примесей возрастает при длительном или неправильном хранении, и при их большом количестве реактив становится непригодным к использованию[10].
Химические свойства
Является сильным восстановителем. Процесс взаимодействия с окислителями происходит в два этапа — на первом гидрохинон превращается в хингидрон, на втором — в 1,4-бензохинон[9].
При взаимодействии с водным раствором карбоната калия при 130 °С превращается в 2,5-дигидроксибензойную кислоту, с метиламином под давлением при 200 °С образует 4-метиламинофенол, с малеиновым ангидридом — нафтазарин, с фталевым ангидридом дает хинизарин. Образует простые моно- и диэфиры при обработке алкилирующими реагентами[9].
Аналитическое определение
Гидрохинон может быть определён при помощи цветных реакций[9]:
- появление окраски от жёлто-зеленой до золотистой при нагревании гидрохинона до 100 °С с нитритом натрия и разбавленой серной кислотой. При добавлении гидроксида натрия окраска изменяется до жёлто-коричневой[9];
- появление темно-красной окраски при добавлении азотной кислоты, постепенно переходящей в жёлтый цвет[3].
Фотографическое проявление
Обладает проявляющими свойствами, восстанавливая галогениды серебра, например, бромид серебра в щелочных растворах с образованием 1,4-бензохинона и бромоводорода[11] и металлического серебра с общим уравнением:
 .
.
Проявление начинается при pH выше 9,5[12]. Процесс состоит из нескольких стадий[13]:
- в щелочной среде гидрохинон диссоциирует в дианион гидрохинона[14]:

 ;
;
- дианион гидрохинона окисляется на центре проявления скрытого изображения с образованием на первой стадии иона семихинона и 1,4-бензохинона на второй[15]:


 ;
;
- ионы серебра восстанавливаются до металлического серебра[15]:
- .
Реакция присоединения
Единственное известное соединение бензольного ряда, которое вступает в реакцию присоединения по Дильсу-Альдеру:

Образующийся неустойчивый аддукт кетонизируется в дикетоангидрид.
Получение
Изначально гидрохинон был получен из хинона. Разные варианты данного способа по-прежнему применяют для лабораторного получения реактива; для этого, например, проводят восстановление водного раствора 1,4-бензохинона, используя диоксид серы[9][16].
В промышленности синтезируют следующими способами[9]:
- окислением 1,4-диизопропилбензола воздухом, затем проводят кислотный гидролиз полученного бис-гидропероксида с образованием гидрохинона и ацетона;
- гидроксилированием фенола 70 % перекисью водорода при 90 °С с использованием в качестве катализаторов 75 % ортофосфорную кислоту или 65 % хлорную кислоту. В результате реакции образуется смесь гидрохинона и пирокатехина, которую в дальнейшем разделяют ректификацией;
- взаимодействием фенола и ацетона с образованием 4-изопропилфенола, который окисляют перекисью водорода в кислой среде с образованием гидрохинона и ацетона;
- окислением сернокислого анилина двуокисью марганца или хромовой кислотой до 1,4-бензохинона, затем восстанавливают 4-бензохинон порошкообразным железом в воде при 70—80 °С в присутствии гидросульфита натрия с общим выходом реакции 74—84 %.
Технические условия выпуска гидрохинона в СССР и Российской Федерации установлены ГОСТ 19627-74[17]. В соответствии с ним выпускается два сорта реактива — высший и первый. Высший сорт выглядит как белый или серовато-белый порошок и содержит 99,5 % основного вещества, первый — как белый с желтоватым оттенком и содержит 99 % основного вещества[18].
Хотя при промышленном производстве обычно получают достаточно чистый реактив, но при необходимости можно получить большую степень очистки, перекристаллизовав продажный реактив из тщательно обескислороженной воды[19].
Оценка производственных мощностей США по производству гидрохинона составляла порядка 11,3 тыс. тонн в год (по состоянию на 1965 г.)[20].
Применение
Применяется:
- в аналитической химии для определения pH и некоторых ионов металлов[9];
- в фотографии как проявляющее вещество[9];
- в производстве органических красителей, лекарственных средств, фотографических материалов как сырье[9];
- в производстве пищевых продуктов и каучуков как антиоксидант[9];
- в косметике используется в средствах для загара и как краска для волос;[]
- в косметической медицине для отбеливания кожи. Из-за канцерогенности его использование ограничено.[21];
- как ингибитор реакции полимеризации виниловых мономеров[9], в том числе для метилметакрилата, используемого в составе стоматологических композиционных материалов химического отверждения.
Применение в аналитической химии
Используется при[9]:
- фотометрическом определении ниобия и вольфрама;
- титриметрическом определении ионов золота и цезия;
- при определении pH с использованием метода хингидронного электрода, для чего готовят хингидрон в виде эквимолярной смеси хинона и гидрохинона.
Применение в фотографии
Как единственное проявляющее вещество, обычно применяется только в специальных проявителях, предназначенных для получения высокой оптической плотности, например, для целей репродуцирования или полиграфии, либо для получения коричневой окраски на бромосеребряных фотобумагах[18].
Составы с гидрохиноном чувствительны к изменениями температуры: оптимальной является 18 °C, при 19 °C скорость работы нормальная, но уже при 20 °C начинается вуалирование; при снижении температуры до 10 °C проявление практически останавливается и при достижении 5 °C прекращается полностью[18].
Обычно применяется в проявителях вместе с метолом или фенидоном, при этом вуалирующая способность, присущая гидрохинону, исчезает[18].
Правовой статус
По состоянию на 2006 год известно о запрете лекарственных препаратов в Нигерии, содержащих более 5 % гидрохинона, из-за их нецелевого использования, а также о существовании в Германии ограничений на использование препаратов с гидрохиноном, где они могут применяться только для случаев патологической пигментации и не могут применяться для детей и подростков младше 12 лет[21].
Биологическая роль
Обладает слабым дезинфекционным действием, аналогичным тому, который оказывает фенол[9].
Безопасность, охрана труда
В больших количествах токсичен. LD50 составляет 302 мг/кг (крысы, перорально). При попадании в организм окисляется до 4-бензохинона, превращающего гемоглобин в метгемоглобин. Может вызывать поражение глаз — конъюнктивит, и кожи — дерматит. ПДК для аэрозоля составляет 2 мг/м3. Рейтинг NFPA 704: опасность для здоровья: 2, огнеопасность: 1, нестабильность: 1. Подтверждена канцерогенность для животных с неизвестной релевантностью для человека[22][9][3].
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0338.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 1 2 3 Гурлев, 1988, с. 278.
- ↑ 1 2 Стилл, 1976, с. 485.
- ↑ Suzuki, 2006, с. 385.
- ↑ Allen, 2011, с. 257.
- ↑ Suzuki, 2006, с. 385—386.
- ↑ Медведев, 1929.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Карпова, 1988.
- ↑ Гурлев, 1988, с. 279.
- ↑ Редько, 2006, с. 855.
- ↑ Редько, 2006, с. 856.
- ↑ Редько, 2006, с. 863—864.
- ↑ Редько, 2006, с. 863.
- ↑ 1 2 Редько, 2006, с. 864.
- ↑ Прянишников, 1956, с. 112.
- ↑ ГОСТ.
- ↑ 1 2 3 4 Гурлев, 1988, с. 278—279.
- ↑ Стилл, 1976, с. 488.
- ↑ Стилл, 1976, с. 487.
- ↑ 1 2 UN, 2006, с. 116.
- ↑ Fisher Scientific.
Литература
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — 335 с. — ISBN 5-335-00125-4.
- Карпова Н. Б. Гидрохинон : статья // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 570. — 623 с.
- Медведев С. Гидрохинон : статья // Техническая энциклопедия / гл. ред. Мартенс Л. К.. — М. : Акционерное общество «Советская энциклопедия», 1929. — Т. 5. — С. 569.
- Мономеры для поликонденсации / под ред. Дж. Стилла, Т. У. Кэмпбелла; пер. с англ. Выгодского Я. С., ред. Коршак В. В. — Мир, 1976.
- Прянишников Н. Д. Практикум по органической химии. — М.: Государственное научно-техническое издательство химической литературы, 1956. — 244 с.
- Редько А. В. Химия фотографических процессов. — СПб. : НПО "Профессионал", 2006. — С. 837—954. — 1464 с. — (Новый справочник химика и технолога / ред. Москвин А. В. ; вып. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии.). — ISBN 978-5-91259-013-9.
- ST/ESA/282: Сводный список товаров, потребление и/или продажа которых запрещены, которые изъяты, строго ограничены или не утверждены правительствами. Лекарственные средства. — восьмое издание. — Нью-Йорк: Организация Объединённых Наций, 2006. Архивная копия от 22 октября 2019 на Wayback Machine
- Allen E., Triantaphillidou S. The Manual of Photograpy. — 10th edition. — 2011.
- Suzuki R. Developing processes : статья // Encyclopedia of twentieth-century photography / Warren L., editor. — New York : Routledge: Tailor & Francis Group LLC, 2006. — Т. Volume 1: A—F Index. — С. 382—389.
- Fieser F. Louis, Fieser Mary, Advanced Organic Chemistry. New York, Chapman $ Hall, 1961 p.295
Ссылки
- ГОСТ 19627-74 Гидрохинон (парадиоксибензол). Технические условия (с Изменениями N 1, 2, 3). Государственный комитет СССР по стандартам. Дата обращения: 19 ноября 2017.
- Тищенко В. Е., Менделеев Д. И., Липский А. А. Гидрохинон // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Hydroquinone, Lab Grade. Safety Data Sheet (англ.). Fisher Scientific. Дата обращения: 19 ноября 2017.


![{\displaystyle {\ce {\ +2AgBr{->[{\ce {OH^{-}}}]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d65de52f484267f9ac79e3e5f8ddf45e42712c63)

![{\displaystyle {\ce {\ <=>[{\ce {OH^-}}][{\ce {H^+}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b20db654d8ac1a36583d6078b9e4e8e58b76883)

![{\displaystyle {\ce {\ <=>[{\ce {-e^-}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7da69b2776ae47d66b0ee6878b13f71534e2581e)