
Ферме́нты, или энзи́мы , — обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам: АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу.

Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс и другие комплексы.
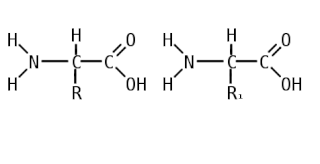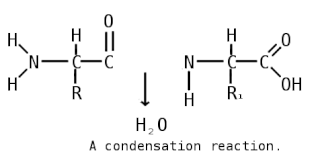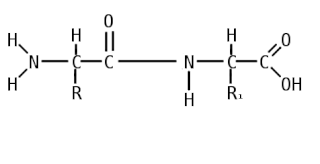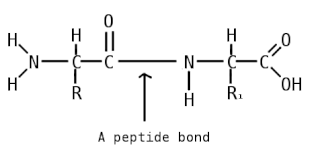
Пепти́ды — семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединённых в цепь пептидными (амидными) связями −C(O)NH−. Обычно подразумеваются пептиды, состоящие из  -аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.
-аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.

Гликопротеи́ны — двухкомпонентные белки, в которых белковая (пептидная) часть молекулы ковалентно соединена с одной или несколькими группами гетероолигосахаридов. Кроме гликопротеинов существуют также протеогликаны и гликозаминогликаны.
Пептидогликан — гетерополимер N-ацетилглюкозамина и N-ацетилмурамовой кислоты, сшитый через лактатные остатки N-ацетилмурамовой кислоты короткими пептидными цепочками. Важнейший компонент клеточной стенки бактерий, выполняющий механические функции, осмотической защиты клетки, выполняет антигенные функции. Характерен только для бактерий и для глаукоцистофитовых водорослей. Аминокислотный состав пептидных цепочек является систематическим признаком.
Протеогликаны — сложные белки. Высокомолекулярные соединения, состоящие из белка с высокой степенью гликозилирования, углеводные остатки которых представляют собой длинные неразветвленные полисахаридные цепи — гликозаминогликаны, образованные чередующимися остатками гексозамина и уроновой кислоты либо галактозы. Гликозаминогликановые цепи зачастую сульфированы. Протеогликаны являются подклассом большого класса сложных белков, которые называются гликопротеинами. Гликопротеины тоже содержат полисахаридные цепи разной длины, ковалентно присоединённые к полипептидной основе, но углеводный компонент гликопротеинов гораздо меньше по массе, чем у протеогликанов, и составляет не более 40% от общей массы.
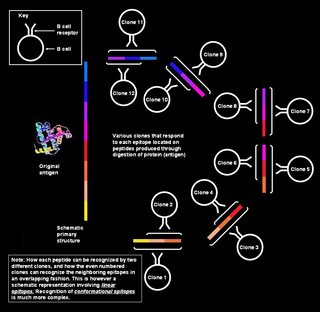
Эпитоп, или антигенная детерминанта — часть макромолекулы антигена, которая распознаётся иммунной системой. Часть антитела, распознающая эпитоп, называется паратопом. Хотя обычно эпитопы относятся к чужеродным для данного организма молекулам, участки собственных молекул, распознаваемые иммунной системой, также называются эпитопами.

Посттрансляционная модификация — это ковалентная химическая модификация белка после его синтеза на рибосоме. Для многих белков посттрансляционная модификация оказывается завершающим этапом биосинтеза, который является частью процесса экспрессии генов. Наряду с альтернативным сплайсингом посттрансляционные модификации увеличивают разнообразие белков в клетке.
Цитохромы (гемопротеины) — это крупные мембранные белки, которые содержат ковалентно связанный гем, расположенный во внутреннем кармане, образованном аминокислотными остатками.

Хемоки́ны (англ. chemokines от chemotactic cytokine) — большое семейство структурно-гомологичных цитокинов, которые стимулируют передвижение лейкоцитов и регулируют их миграцию из крови в ткани. У человека имеется около 50 хемокинов, которые представляют собой полипептиды массой от 8 до 10 кДа, содержащие две дисульфидные связи. Выделяют четыре основных группы хемокинов: CXC, CC, CX3C и C. Действие всех хемокинов опосредовано взаимодействием с особыми рецепторами хемокинов, которые представляют собой связанные с G-белками трансмембранные рецепторы. Хемокиновые рецепторы встречаются только на поверхности клеток-мишеней, которыми выступают различные лимфоциты.
Иминогру́ппа — молекулярная группа NH. Двухвалентна. Содержится во вторичных аминах и пептидах.

Протеолиз — процесс гидролиза белков, катализируемый ферментами пептидгидролазами, или протеазами.

Мозговой натрийуретический пептид (МНП), также известен, как натрийуретический пептид типа В (BNP) или GC-B, представляет собой пептидный гормон. Продуцируется клетками предсердий сердца — кардиомиоцитами в ответ на чрезмерное растяжение клеток сердечной мышцы. Синтез мозгового натрийуретического пептида модулируется ионами кальция. Мозговой натрийуретический пептид назван так, потому что он первоначально был идентифицирован в экстрактах головного мозга свиньи, хотя у людей он синтезируется в основном в желудочках сердца.
Суперсемейство белков — это наиболее крупная единица группировки белков, для которых может быть предположено наличие общего эволюционного предка. Обычно суперсемейство объединяется по принципу сходства вторичных и третичных структур белков, входящих в него и по принципу сходства механизма действия белков, несмотря на то, что сходства аминокислотных последовательностей в пределах суперсемейства может не наблюдаться и чаще всего не наблюдается. Суперсемейства обычно содержат несколько семейств белков, которые проявляют сходство аминокислотных последовательностей внутри семейств, но не между семействами. Термин «клан белков» часто применяется по отношению к суперсемействам протеаз, на основании классификации MEROPS.
Остаток в биохимии и молекулярной биологии — структурная единица биополимера, состоящего из аминокислот и сахаров; часть мономера, которая остаётся неизменной после включения его в биополимер. Например, остатками принято называть аминокислотные звенья, входящие в состав пептида. Остатки уже не являются аминокислотами, так как в результате реакции конденсации, они утратили по одному атому водорода из аминогруппы и гидроксил, входящий в состав карбоксильной группы. Кроме того, остатками также считаются N-концевая и C-концевая аминокислоты пептида. Таким образом, остаток в биохимии можно определить, как ту часть молекулы, которая остаётся неизменной после отщепления от неё H+ и/или OH-.

Белки́, зая́коренные липи́дами, или липидосвя́занные белки́ — белки клеточной мембраны, ковалентно связанные с липидами клеточной мембраны. Эти липиды вставлены в мембрану бок о бок с хвостами жирных кислот. Белки, заякоренные липидами, могут находиться с любой стороны клеточной мембраны. Таким образом, липид служит своего рода якорем, закрепляющим белок вблизи клеточной мембраны.

Аци́лперенося́щие белки́ — небольшие водорастворимые белки, важный компонент в биосинтезе жирных кислот и поликетидов, связывающий растущую углеродную цепь через свою простетическую группу — остаток 4′-фосфопантетеина.

OGT — ген, кодирующий гликозилтрансферазу OGT. Фермент OGT гликозилирует белки, катализируя образование O-гликозидной связи между N-ацетилглюкозамином (GlcNAc) и остатками серина или треонина. В качестве источника GlcNAc-группы фермент OGT использует УДФ-N-ацетилглюкозамин. Среди мишеней фермента OGT — множество различных белков, включая метилтрансферазу MLL5, гистон H2B, тау-белок, корегулятор транскрипции HCFC1, киназы AKT1 и PFKL. Для гена OGT обнаружены альтернативно сплайсированные варианты транскриптов, кодирующие различные изоформы фермента. Одна из изоформ белка OGT локализуется в митохондрии, а две других — в цитоплазме и ядре клетки. У человека ген OGT находится на длинном плече X-хромосомы (Xq13); описано несколько точечных мутаций в гене OGT, которые связывают со слабоумием и задержкой развития. Аминокислотная последовательность белка, кодируемого геном OGT, является высококонсервативной в филогенетическом ряду от червей до человека. Нокаут гена OGT у млекопитающих является эмбриолетальным.

Бета-шпилька представляет собой простой структурный мотив белка, включающий две бета-нити, которые похожи на шпильку. Мотив состоит из двух смежных по первичной структуре нитей, ориентированных в антипараллельном направлении, связанных короткой петлей из двух-пяти аминокислот. Бета-шпильки могут встречаться изолированно или как часть ряда нитей, связанных водородными связями, которые вместе составляют бета-лист.
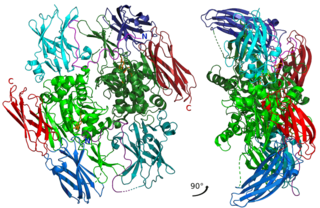
Фактор свёртывания крови XIII, протрансглутаминаза, также фибрин-стабилизирующий фактор или фактор Лаки-Лоранда — представляет собой белок зимоген, обнаруженный в крови человека и некоторых других животных. Он активируется тромбином, путём частичного протеолиза молекул зимогена до фактора XIIIa или трансглутаминазу. Фактор XIIIa представляет собой фермент системы свёртывания крови, сшивающий растворимые молекулы фибрина-мономера, превращая его в более прочную и нерастворимую форму — фибрин-полимер. Дефицит фактора XIII ухудшает стабильность сгустка и увеличивает склонность к кровотечениям. Впервые обнаружен в 1948 году венгерскими биохимиками, изучавшими процесс коагуляции крови — Калманом Лаки и Лазло Лорандом.














