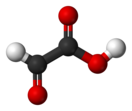
Глиоксиловая кислота
| Глиоксиловая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | Оксоэтановая кислота | ||
| Традиционные названия | Глиоксиловая кислота, Глиоксалевая кислота | ||
| Хим. формула | C2H2O3 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 74,04 г/моль г/моль | ||
| Плотность | 1,34 г/см3 (для 50% водного раствора) | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 80 °C[1] | ||
| • кипения | 111 °C °C | ||
| Классификация | |||
| Рег. номер CAS | 298-12-4 | ||
| PubChem | 760 | ||
| Рег. номер EINECS | 206-058-5 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 16891 | ||
| ChemSpider | 740 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Глиоксиловая (глиоксалевая, оксоэтановая) кислота — органическое вещество, представляющее из себя α-альдегидокислоту. Вместе с уксусной, гликолевой, и щавелевой кислотами относится к группе C2 (двууглеродных) карбоновых кислот. Глиоксиловая кислота является бифункциональным соединением и помимо карбоксильной группы содержит карбонильную группу в α-положении, поэтому классифицируется как оксокислота (не следует путать с окси-, или гидроксикислотами).
Строение и физические свойства
В чистом виде выделить глиоксиловую кислоту невозможно, удается получить лишь её моногидрат. Поэтому данной кислоте также приписывают формулу дигидроксиуксусной кислоты CH(OH)2-COOH. Спектроскопия ЯМР показывает, что в водных растворах кислоты устанавливается равновесие между формой диола и полуацеталя [2]:
При нейтральных pH глиоксиловая кислота существует в водном растворе в диссоциированной форме. Сопряженное основание глиоксиловой кислоты называется глиоксилат анион.
Известно значение константы Генри для глиоксиловой кислоты [3]
Получение
Промышленный способ получения глиоксиловой кислоты основан на реакции окисления глиоксаля 65% горячей (40-90°C) азотной кислотой. Основным побочным продуктом в данной реакции является щавелевая кислота, которая отделяется низкотемпературной кристаллизацией. Глиоксаль также может быть окислен до глиоксиловой кислоты на аноде путём электролиза раствора в присутствии хлоридов. Каталитическое окисление этилена или ацетальдегида обладает низкой селективностью, в связи с чем не используется при промышленном получении глиоксиловой кислоты.
Теоретически, возможно получение глиоксиловой кислоты, окислением акрилонитрила перманаганатом калия в кислой среде (KMnO4+H2SO4), но метод не доказан.
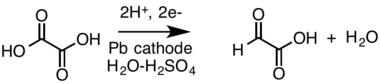
Частичное электровосстановление щавелевой кислоты на катоде, дает достаточно хороший выход реакции (85%), однако связано с техническими трудностями, обусловленными пассивацией свинцового электрода. Данный способ получения глиоксиловой кислоты был предложен в 1904 году швейцарским химиком Юлиусом Тафелем[4][5]:
В качестве эффективного способа получения может быть назван озонолиз малеиновой кислоты[2].
Также глиоксиловую кислоту можно получить гидратацией дихлоруксусной и дибромуксусной кислот [6].
Химические свойства и использование
Как и другие α-альдегидо- и α-кетокислоты глиоксиловая кислота более сильная чем уксусная и пропионовая. Это обусловленно стабилизирующим действием карбонильной группы на анионы α-альдо- и α-кетокислот [7]. Значение константы диссоциации для глиоксиловой кислоты: 4.7 × 10−4 (pKa = 3.33):
- (HO)2CHCOOH (HO)2CHCO2− + H+
При нагревании и реакции с горячими щелочами происходит диспропорционирование глиоксиловой кислоты с образование гликолевой и щавелевой кислоты или соответствующих солей:
- 2 OCHCOOH + H2O → HOCH2COOH + HOOC–COOH
- 2 OCHCOOH + 3 KOH → HOCH2COOK + KOOC–COOK + 2 H2O
Глиоксиловая кислота легко окисляется азотной кислотой с образованием щавелевой кислоты.
Глиоксиловая кислота проявлет некоторые типичные свойства альдегидов. В частности глиоксалевая кислота образует гетероциклические соединения в реакциях нуклеофильного присоединения с мочевиной, с 1,2-диаминобензолом.
Для глиоксиловой кислоты характерны разнообразные реакции конденсации с фенолами, которые используются в органическом синтезе.
Использование в органическом синтезе
При реакции конденсации с фенолом образуется 4-гидроксиминдальная кислота. Восстановление 4-гидроксиминдальной кислоты позволяет получить 4-гидроксифенилуксусную кислоту, являющуюся важным предшественником в синтезе многих лекарственных препаратов (например при синтезе атенолола).
При реакции с гваяколом образуется ванилилминдальная кислота, окислительное декарбоксилирование которой позволяет получить ванилин ("лигниновый способ") [2][8][9].

Глиоксиловая кислота является исходным компонентом при синтезе хелатора иона Fe3+ EHPG (N,N-ethylenebis[2-(2-hydroxyphenyl)glycine])[2]. Комплекс EHPG и трехвалентного железа рассматривается как потенциальное контрастное вещество при магнитнорезонансоном исследовании[10][11].
Также глиоксиловая кислота используется для синтеза 4-гидроксофенилглицина, который является интермедиатом при полусинтетическом получении амоксициллина.
Реакция Хопкинса-Кола на триптофан
Глиоксиловая кислота является одним из компонентов реактива Хопкинса-Кола (Hopkins, Cole). Данный реагент применяется в биохимии для детекции остатков триптофана в белках[12][13][14].
Нахождение и роль в природе
Глиоксиловая кислота содержится в незрелых фруктах, по мере созревания её количество уменьшается [6].
Глиоксиловая кислота является компонентом многих метаболических путей живых организмов. Глиоксилат является интермедиатом глиоксилатного цикла, который позволяет многим живым организмам, таким как бактерии[15], грибы и растения[16] конвертировать жирные кислоты в углеводы. Кроме того в клетках растений глиоксилат образуется в пероксисомах результате окисления гликолата в ходе фотодыхания (гликолатный цикл).
Токсикология
ЛД50 для крыс при оральном введении составляет 2500 мг/кг. Мутагенный эффект не обнаружен[2].
Примечания
- ↑ Merck Index, 11th Edition, 4394
- ↑ 1 2 3 4 5 Georges Mattioda and Yani Christidis “Glyoxylic Acid” Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a12_495
- ↑ Ip, H. S. Simon; Huang, X. H. Hilda; Yu, Jian Zhen. Effective Henry's law constants of glyoxal, glyoxylic acid, and glycolic acid (англ.) // Geophysical Research Letters[англ.] : journal. — Vol. 36, no. 1. — doi:10.1029/2008GL036212.
- ↑ Tafel, Julius; and Friedrichs, Gustav. Elektrolytische Reduction von Carbonsäuren und Carbonsäureestern in schwefelsaurer Lösung (нем.) // Berichte der deutschen chemischen Gesellschaft[англ.] : magazin. — 1904. — Bd. 37, Nr. 3. — S. 3187—3191. — doi:10.1002/cber.190403703116. Архивировано 18 мая 2014 года.
- ↑ Cohen, Julius. Practical Organic Chemistry 2nd Ed (неопр.). — London: Macmillan and Co. Limited, 1920. — С. 102—104. Архивировано 24 сентября 2015 года.
- ↑ 1 2 Грандберг И.И. Органическая химия: Учб. для студ. вузов - М.: Дрофа, 2004. - 672 с. ISBN 5-7107-8771-X
- ↑ Травень В.Ф. Органическая химия: учебник для вузов: в 2 т. - М.: ИКЦ "Академкнига", 2008. - ISBN 978-5-94628-318-2
- ↑ Fatiadi, Alexander; and Schaffer, Robert. [http://nvlpubs.nist.gov/nistpubs/jres/78A/jresv78An3p411_A1b.pdf An Improved Procedure for Synthesis of DL-4-Hydroxy-3-methoxymandelic Acid (DL-"Vanillyl"-mandelic Acid, VMA)] (англ.) // Journal of Research of the National Bureau of Standards - A. Physics and Chemistry : journal. — 1974. — Vol. 78A, no. 3. — P. 411—412. — doi:10.6028/jres.078A.024. Архивировано 19 декабря 2013 года.
- ↑ Kamlet, Jonas; and Mathieson, Olin. Manufacture of vanillin and its homologues U.S. Patent 2,640,083 (англ.). — U.S. Patent Office, 1953. Архивировано 30 апреля 2021 года.
- ↑ Kuźnik N., Jewuła P., Oczek L., Kozłowicz S., Grucela A., Domagała W. EHPG iron(III) complexes as potential contrast contrast agents for MRI (неопр.) // Acta Chim Slov.. — 2014. — Т. 61. — С. 87—93. — PMID 24664331.
- ↑ Liu G. C., Wang Y. M., Jaw T. S., Chen H. M., Sheu RS. Fe(III)-EHPG and Fe(III)-5-Br-EHPG as contrast agents in MRI: an animal study (англ.) // J Formos Med Assoc : journal. — 1993. — Vol. 92. — P. 359—366. — PMID 8104585.
- ↑ R.A. Joshi. Question Bank of Biochemistry (неопр.). — New Age International, 2006. — С. 64. — ISBN 978-81-224-1736-4. Архивировано 11 января 2023 года.
- ↑ Debajyoti Das. Biochemistry (неопр.). — Academic Publishers, 1980. — С. 56. — ISBN 978-93-80599-17-5. Архивировано 11 января 2023 года.
- ↑ P. M. Swamy. Laboratory Manual on Biotechnology (неопр.). — Rastogi Publications, 2008. — С. 90. — ISBN 978-81-7133-918-1.
- ↑ Holms W. H. Control of flux through the citric acid cycle and the glyoxylate bypass in Escherichia coli (англ.) // Biochem Soc Symp. : journal. — 1987. — Vol. 54. — P. 17—31. — PMID 3332993.
- ↑ Escher C. L., Widmer F. Lipid mobilization and gluconeogenesis in plants: do glyoxylate cycle enzyme activities constitute a real cycle? A hypothesis (англ.) // Biol Chem.[англ.] : journal. — 1997. — Vol. 378, no. 8. — P. 803—813. — PMID 9377475.
Ссылки
- Колотов С.С., Менделеев Д. И. Глиоксалевая кислота // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.

![{\displaystyle {\ce {2CH(HO)2-COOH <=> O[(HO)CH-COOH]2{+}H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af7ad02a4d960433307a4aef58367440ca43a5ee)
![{\displaystyle K_{H}=1.09\times 10^{4}\times \exp[(40.0\times 10^{3}/R)\times (1/T-1/298)]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b877b00a51f022e292a5054ebe2bf9dc553c440)