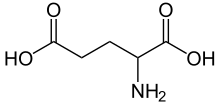
Глутами́новая кислота́ (2-аминопентандио́вая кислота) — органическое соединение, алифатическая двухосновная аминокислота, входящая в состав белков всех известных живых организмов.

Ферме́нты, или энзи́мы , — обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам: АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу.
Глико́лиз, или путь Эмбдена — Мейергофа — Парнаса — процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты. Гликолиз состоит из цепи последовательных ферментативных реакций и сопровождается запасанием энергии в форме АТФ и НАДH. Гликолиз является универсальным путём катаболизма глюкозы и одним из трёх путей окисления глюкозы, встречающихся в живых клетках. Реакция гликолиза в суммарном виде выглядит следующим образом:
- Глюкоза + 2НАД+ + 2АДФ + 2Pi → 2 пируват + 2НАД*H + 2Н+ + 2АТФ + 2Н2O.
Глюконеогене́з — метаболический путь, приводящий к образованию глюкозы из неуглеводных соединений. Наряду с гликогенолизом, этот путь поддерживает в крови уровень глюкозы, необходимый для работы многих тканей и органов, в первую очередь, нервной ткани и эритроцитов. Он служит важным источником глюкозы в условиях недостаточного количества гликогена, например, после длительного голодания или тяжёлой физической работы. Глюконеогенез является обязательной частью цикла Кори, кроме того, этот процесс может быть использован для превращения пирувата, образованного при дезаминировании аминокислот аланина и серина.

Ци́кл трикарбо́новых кисло́т (сокр. ЦТК, цикл Кре́бса, цитра́тный цикл, цикл лимо́нной кислоты́) — центральная часть общего пути катаболизма, циклический биохимический процесс, в ходе которого ацетильные остатки (СН3СО-) окисляются до диоксида углерода (CO2). При этом за один цикл образуется 2 молекулы CO2, 3 НАДН, 1 ФАДH2 и 1 ГТФ (или АТФ). Электроны, находящиеся на НАДН и ФАДH2, в дальнейшем переносятся на дыхательную цепь, где в ходе реакций окислительного фосфорилирования образуется АТФ.
Трансфера́зы (КФ2) — отдельный класс ферментов, катализирующих перенос функциональных групп и молекулярных остатков от одной молекулы к другой. Широко распространены в растительных и животных организмах, участвуют в превращениях углеводов, липидов, нуклеиновых и аминокислот.

Митохо́ндрия — двумембранная сферическая или эллипсоидная органелла диаметром обычно около 1 микрометра. Характерна для большинства эукариотических клеток, как автотрофов, так и гетеротрофов. Энергетическая станция клетки; основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии для генерации электрического потенциала, синтеза АТФ и термогенеза. Эти три процесса осуществляются за счёт движения электронов по электронно-транспортной цепи белков внутренней мембраны. Количество митохондрий в клетках различных организмов существенно отличается: так, одноклеточные зелёные водоросли и трипаносомы имеют лишь одну гигантскую митохондрию, тогда как ооцит и амёба Chaos chaos содержат 300 000 и 500 000 митохондрий соответственно; у кишечных анаэробных энтамёб и некоторых других паразитических простейших митохондрии отсутствуют. В специализированных клетках органов животных содержатся сотни и даже тысячи митохондрий.
Катаболи́зм, также энергетический обмен, или диссимиляция — процесс метаболического распада (деградации) сложных веществ на более простые или окисления какого-либо вещества, обычно протекающий с освобождением энергии в виде тепла и в виде молекулы АТФ, универсального источника энергии всех биохимических процессов. Катаболические реакции лежат в основе диссимиляции: утраты сложными веществами своей специфичности для данного организма в результате распада до простых.

Малатдегидрогеназа (Дегидрогеназа яблочной кислоты, англ. MDH, EC 1.1.1.37 — фермент, катализирующий окисление S-малата до оксалоацетата.

Глутамин — одна из 20 стандартных аминокислот, входящих в состав белка. Глутамин полярен, не заряжен и является амидом моноаминодикарбоновой глутаминовой кислоты, образуясь из неё в результате прямого аминирования под воздействием глутаминсинтетазы.

Трансаминирование — биохимическая ферментативная реакция обратимого переноса аминогруппы с аминокислоты на кетокислоту без промежуточного образования аммиака.
Декарбоксилирование аминокислот — процесс отщепления карбоксильной группы аминокислот в виде CO2.

Флавины — группа органических соединений - производных диметилизоаллоксазина ( ), замещенных обычно по положению 10.

α-Кетоглутаровая (альфа-кетоглутаровая) кислота — одно из двух кетоновых производных глутаровой кислоты. Название «кетоглутаровая кислота» без дополнительных обозначений обычно означает альфа-форму. Отличается от β-кетоглутаровой кислоты только положением кетонной функциональной группы и встречается гораздо реже.
Углеводный обмен, или метаболизм углеводов в организмах животных и человека. Метаболизм углеводов в организме человека состоит из следующих процессов:
- Расщепление в пищеварительном тракте поступающих с пищей поли- и дисахаридов до моносахаридов, дальнейшее всасывание моносахаридов из кишечника в кровь.
- Синтез и распад гликогена в тканях, прежде всего в печени.
- Гликолиз — распад глюкозы. Первоначально под этим термином обозначали только анаэробное брожение, которое завершается образованием молочной кислоты (лактата) или этанола и углекислого газа. В настоящее время понятие «гликолиз» используется более широко для описания распада глюкозы, проходящего через образование глюкозо-6-фосфата, фруктозо-1,6-дифосфата и пирувата как в отсутствие, так и в присутствии кислорода. В последнем случае употребляется термин «аэробный гликолиз», в отличие от «анаэробного гликолиза», завершающегося образованием молочной кислоты или лактата.
- Анаэробный путь прямого окисления глюкозы или, как его называют, пентозофосфатный путь.
- Взаимопревращение гексоз.
- Анаэробный метаболизм пирувата. Этот процесс выходит за рамки углеводного обмена, однако может рассматриваться как завершающая его стадия: окисление продукта гликолиза — пирувата.
- Глюконеогенез — образование углеводов из неуглеводных продуктов.
Общий путь катаболизма — совокупность биохимических процессов, которая включает в себя:
- окисление пирувата до ацетил-КоА;
- окисление ацетил-КоА в цикле трикарбоновых кислот;
Бе́та-окисле́ние (β-окисление), также цикл Кноопа — Линена, — метаболический процесс деградации жирных кислот. Своё название процесс получил по 2-му углеродному атому (С-3 или β-положение) от карбоксильной группы (-СООН) жирной кислоты, который подвергается окислению и последовательному отделению от молекулы. Продуктами каждого цикла β-окисления являются ФАДH2, НАДH и ацетил-КоА. Реакции β-окисления и последующего окисления ацетил-КоА в цикле Кребса служат одним из основных источников энергии для синтеза АТФ по механизму окислительного фосфорилирования.

Митохондриа́льный ма́трикс или просто ма́трикс — ограниченное внутренней мембраной пространство, расположенное внутри митохондрий. Слово «матрикс» происходит из того, что эта среда является намного более вязкой по сравнению с более водянистой цитоплазмой. В состав матрикса входит множество веществ, включая ферменты, митохондриальную ДНК (кольцевая), рибосомы, малые органические молекулы, нуклеотидные коферменты и неорганические ионы. Ферменты матрикса содействуют реакциям биохимических процессов, в ходе которых синтезируется АТФ, таких как цикл трикарбоновых кислот, окислительное фосфорилирование, окисление пирувата и бета-окисление жирных кислот.
Сукцинат-полуальдегид-дегидрогеназа (НАДФ+) (Шифр КФ 1.2.1.79, Дегидрогеназа янтарного полуальдегида (НАДФ+), сукцинат-полуальдегид-дегидрогеназа (НАДФ+), сукцинат полуальдегид:НАДФ+ оксидоредуктаза, НАДФ-зависимая сукцинат-полуальдегид-дегидрогеназа, GabD) — фермент, систематическое название которого сукцинат-полуальдегид:НАДФ+ оксидоредуктаза. Фермент катализирует следующую химическую реакцию:
- сукциниловый полуальдегид + НАДФ+ + Н2О
 сукцинат + НАДФН + 2 H+
сукцинат + НАДФН + 2 H+
Транслоказы — отдельный класс ферментов, катализирующих перенос ионов или молекул через мембраны или их разделение в мембранах. Этот класс ферментов сформировался из ранее принадлежащих другим классам ферментов.