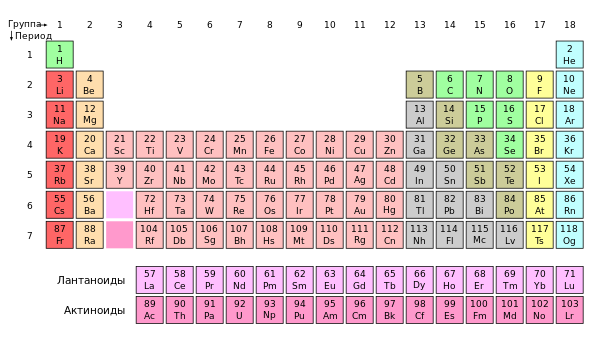
Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс.

Периоди́ческая систе́ма хими́ческих элеме́нтов — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда их атомного ядра. Периодическая таблица была представлена независимо и почти одинаково двумя химиками в 1869 году: сначала русским Дмитрием Менделеевым, а через несколько месяцев немцем Лотаром Мейером и приведена к традиционному графическому виду в 1871 году. Всего предложено несколько сотен вариантов изображения периодической системы. В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.

Моле́кула — электрически нейтральная частица, образованная из двух или более связанных атомов.
Эле́ктроотрица́тельность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, то есть способность атомов притягивать к себе электроны других атомов. Самая высокая степень электроотрицательности у галогенов и сильных окислителей, а низкая — у активных металлов.
Сте́пень окисле́ния — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле.

Празеоди́м — химический элемент 3-й группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 59.
Проме́тий — химический элемент 3-й группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 61.
Фе́рмий — радиоактивный трансурановый химический элемент 3-й группы седьмого периода периодической системы химических элементов Д.И. Менделеева с атомным номером 100.
Менделе́вий — химический элемент 3-й группы седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 101. Относится к семейству актиноидов.
Благоро́дные га́зы — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса, с очень низкой химической реактивностью. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы и скорее всего будут близки к свойствам металлоидов, таких как астат (At) и теллур (Te).
Полупроводни́к — материал, по удельной проводимости занимающий промежуточное место между проводниками и диэлектриками, и отличающийся от проводников (металлов) сильной зависимостью удельной проводимости от концентрации примесей, температуры и воздействия различных видов излучения. Основным свойством полупроводников является увеличение электрической проводимости с ростом температуры.

Вале́нтность — способность атомов образовывать определённое количество химических связей, которые образует атом, или число атомов, которое может присоединить или заместить атом данного элемента.

Ковале́нтная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Пери́од — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки, где в каждый период входят элементы с одинаковым количеством электронных оболочек.

Акце́птор — в физике твёрдого тела примесь в кристаллической решётке, которая придаёт кристаллу дырочный тип проводимости, при которой носителями заряда являются дырки. Термин имеет смысл при ковалентном типе связей между атомами в кристалле.

В химии валентными электронами называют электроны, находящиеся на внешней (крайней) оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях, то есть они участвуют в образовании химической связи и завершают электронный слой атомов, участвующих в ней. Чем меньше валентных электронов имеет элемент, тем легче он приобретает электроны в реакциях с другими элементами. И наоборот, чем больше валентных электронов содержится в атоме химического элемента, тем легче он отдаёт эти электроны в химических реакциях при прочих равных условиях. Полностью заполненные внешние электронные оболочки имеют инертные газы, которые проявляют минимальную химическую активность. Периодичность заполнения электронами внешней электронной оболочки определяет периодическое изменение химических свойств элементов в таблице Менделеева.
Элладская цивилизация, или Элладский период в истории Греции — современный археологический термин, обозначающий ряд исторических периодов эпохи бронзового века на территории материковой Греции, включая возникновение крито-микенской цивилизации. В трудах античных историков и поэтов нередко упоминаются догреческие обитатели Эллады — чаще всего пеласги, реже другие народы, однако в ходе Элладского периода они были, по-видимому, постепенно покорены и ассимилированы приобретающими всё большее влияние греками, язык и культура которых становятся доминирующими к моменту возникновения первых письменных источников материковой Греции.

Короткая форма периодической системы элементов — один из способов изображения периодической системы химических элементов, восходящий к первоначальной версии таблицы Д. И. Менделеева. Короткая форма таблицы Менделеева основана на параллелизме степеней окисления элементов главных и побочных подгрупп: например, максимальная степень окисления ванадия равна +5, как у фосфора и мышьяка, максимальная степень окисления хрома равна +6, как у серы и селена, и так далее. В таком виде таблица была опубликована Менделеевым в 1871 году.
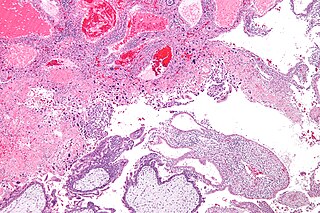
Трофобластическая болезнь — заболевание, в основе которого лежит нарушение развития и роста трофобласта, сопровождающееся последовательными морфологическими изменениями от пузырного заноса до хориокарциномы с соответствующими биологическими и клиническими признаками. Проявляется тремя основными формами: синцитиальным эндометритом, пузырным заносом и хорионэпителиомой. Заболевание чаще всего встречается в Юго-Восточной Азии и островах Тихого океана и относительно редко — в Европейских странах и США. Уникальность данного заболевания в том, что эти опухоли представляют собой аллотрансплантанты, которые возникают в момент зачатия и в случае злокачественной трансформации происходит прорастание в ткани материнского организма, а также метастазирование.
До́норно-акце́пторное взаимоде́йствие — перенос заряда между молекулами донора и акцептора без образования между ними химической связи ; или передача неподеленной электронной пары от донора к акцептору, приводящая к образованию связи.