Протео́мика — область молекулярной биологии, посвящённая идентификации и количественному анализу белков. Термин «протеомика» был предложен в 1997 году. Совокупность всех белков клетки называют протеомом.

Молекуля́рная биоло́гия — наука, академическая дисциплина, раздел биологии, изучающий структуру, взаимодействие молекул и макромолекулярных систем, участвующих в биологических процессах живых организмов, молекулярные основы наследственности и синтеза белка.
Секвени́рование биополимеров — определение их аминокислотной или нуклеотидной последовательности. В результате секвенирования получают формальное описание первичной структуры линейной макромолекулы в виде последовательности мономеров в текстовом виде. Размеры секвенируемых участков ДНК обычно не превышают 100 пар нуклеотидов и 1000 пар нуклеотидов при секвенировании по Сенгеру. В результате секвенирования перекрывающихся участков ДНК получают последовательности участков генов, целых генов, тотальной мРНК или полных геномов организмов.

Электрофоре́з — это электрокинетическое явление перемещения частиц дисперсной фазы в жидкой или газообразной среде под действием внешнего электрического поля. Впервые было открыто профессорами Московского университета П. И. Страховым и Ф. Ф. Рейссом в 1809 году.

Ге́ли — структурированные системы, состоящие из высокомолекулярных и низкомолекулярных веществ. Наличие трёхмерного полимерного каркаса даёт гелям механические свойства твёрдых тел: отсутствие текучести, способность сохранять форму, прочность и способность к деформации.

Арне Тиселиус — шведский биохимик, член Шведской АН и её президент с 1956 года. Лауреат Нобелевской премии (1948).

Электрофоре́з белко́в — способ разделения смеси белков на фракции или индивидуальные белки, основанный на движении заряженных белковых макромолекул различного молекулярного веса в стационарном электрическом поле. Электрофорез белков применяют как для анализа компонентов смеси белков, так и для получения гомогенного белка. Наиболее распространенным вариантом электрофоретического анализа белков является электрофорез белков в полиакриламидном геле по Лэммли.
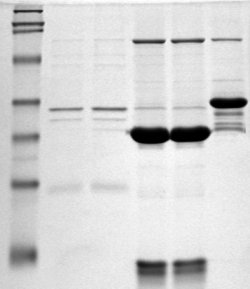
Электрофорез белков в полиакриламидном геле — метод разделения смесей белков в полиакриламидном геле в соответствии с их электрофоретической подвижностью. Данный способ фракционирования белков и пептидов широко применяют в современной молекулярной биологии, биохимии, генетике.
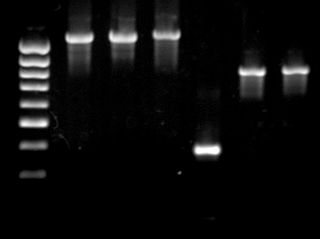
Электрофорез ДНК в агарозном геле — аналитический метод, применяемый для разделения фрагментов ДНК по длине. Основан на разной скорости движения фрагментов разной длины при движении в геле под действием внешнего электрического поля.
Электрофорез в полиакриламидном геле — метод молекулярной биологии и биохимии, используемый для разделения белков и нуклеиновых кислот, основанный на движении заряженных биологических макромолекул в постоянном электрическом поле. Разделение в полиакриламидном геле происходит за счёт различий заряда разделяемых молекул и отличий молекулярных масс, а также от конфигурации молекул. Различают т. н. неденатурирующий, или нативный ПААГ-электрофорез и денатурирующий ПААГ-электрофорез. В процессе денатурирующего ПААГ-электрофореза молекулы сохраняются в денатурированном состоянии за счёт наличия в геле хаотропных агентов в случае ПААГ-электрофореза нуклеиновых кислот и белков и наличия ионных и неионных детергентов.
- В случае электрофореза белков в полиакриламидном геле метод обычно используют в модификации Леммли (Laemmli)
- Также электрофорез в полиакриламидном геле применяют для разделения коротких фрагментов нуклеиновых кислот, например, ДНК-электрофорез, например, при секвенировании по Сэнгеру. Кроме этого, ПААГ-электрофорез применяют для визуализации в методах ПДРФ и ПЦР.
- Различают также т. н. диск-электрофорез, при котором в геле в процессе электрофоретического разделения белков на границе между концентрирующим и разделяющим гелями создаётся градиент pH, за счёт чего достигается лучшее разделение белковых молекул.

Ге́рман Васи́льевич Тро́ицкий — советский биохимик, доктор биологических наук, кандидат медицинских наук, профессор, заслуженный деятель науки Украины, лауреат премии имени А. В. Палладина АН Украины, член-корреспондент Академии наук Украины. В течение долгого времени заведовал кафедрой биологической химии Крымского медицинского института, является основателем Крымской биохимической школы.
Футпринтинг ДНК — метод поиска в структуре ДНК последовательностей связывания ДНК-связывающих белков. Данный метод используют для изучения взаимодействия белков с ДНК как in vitro, так и in vivo.
Вестерн-блоттинг — аналитический метод, используемый для определения в образце специфичных белков. На первом этапе используют электрофорез белков в полиакриламидном геле для разделения денатурированных полипептидов по длине или по трехмерной структуре белка. Далее белки переносят на нитроцеллюлозную или PVDF-мембрану, затем детектируют с использованием антител, специфичных к заданному белку.
Блоттинг — общее название методов молекулярной биологии по переносу определённых белков или нуклеиновых кислот из раствора, содержащего множество других молекул, на какой-либо носитель в целях последующего анализа. В одних случаях молекулы предварительно подвергаются гель-электрофорезу, в других — переносятся непосредственно на мембрану. После блоттинга молекулы визуализируются посредством различных методов:
- Окрашивание.
- Авторадиографическая визуализация.
- Специфическое маркирование с помощью иммунохимических методов или гибридизации.
Белковая инженерия — раздел биотехнологии, который занимается разработкой полезных или ценных белков. Это относительно новая дисциплина, которая направлена на исследование фолдинга белков и принципов модификации и создания белков.

Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт биомедицинской химии имени В. Н. Ореховича» (ИБМХ) — институт, занимающийся проблемами биологической и медицинской химии.
Секрето́мика — раздел протеомики, изучающий все секретируемые белки клетки, ткани или организма. Секретируемые белки не только вовлечены во множество различных физиологических процессов, включая передачу клеточного сигнала и ремоделирование внеклеточного матрикса, но и являются неотъемлемой частью инвазии и метастазирования злокачественных клеток. Секретомика, таким образом, важна в выявлении биомаркеров рака.
Александр Александрович Терентьев — российский биохимик, член-корреспондент РАМН (2005), член-корреспондент РАН (2014).
Протеогеномика — это область биологических исследований, в которой используется сочетание протеомики, геномики и транскриптомики, с целью обнаружения и идентификации пептидов. Протеогеномика применяется для идентификации новых пептидов путем сравнения спектров МС/МС с базой данных белков, которая была получена из геномной и транскриптомной информации. Протеогеномика часто относится к исследованиям, использующим протеомную информацию, полученную, например, методом масс-спектрометрии, для улучшения аннотаций генома. Геномика изучает ДНК и генетический код целых организмов, в то время как транскриптомика имеет дело с последовательностями РНК и транскриптов. Протеомика использует тандемную масс-спектрометрию и жидкостную хроматографию для определения и изучения функций белков. Протеомика используется для обнаружения всех белков, экспрессируемых в организме, известных как его протеом. Нерешённая проблема протеомики заключается в том, что она основывается на предположении, что современные модели генов верны и что правильные последовательности белка можно найти с помощью базы данных эталонных последовательностей; Однако это не всегда так, поскольку некоторые пептиды не могут быть найдены в базах данных. Кроме того, новые белковые последовательности могут возникать в результате мутаций. Данная проблема может быть решена с использованием протеомных, геномных и транскриптомных данных. Совместное использование методов протеомики и геномики привело к появлению протеогеномики, которая выделилась в самостоятельную область в 2004 году.

Капиллярный электрофорез-масс-спектрометрия (КЭ-МС) — метод аналитической химии, основанный на комбинации капиллярного электрофореза с масс-спектрометрией. КЭ-МС сочетает в себе преимущества КЭ и МС, обеспечивая высокую эффективность разделения и предоставляя полную информацию о молекулярной массе веществ в единичном анализе. Метод обладает высокой разрешающей способностью, чувствительностью, скоростью анализа, при этом требуется минимальный объем образца. Ионы обычно получают путем ионизации электрораспылением, но они также могут быть образованы методом матричной лазерной десорбции / ионизации или с помощью других способов ионизации. Метод нашел применение для фундаментальных исследований в области протеомики и количественного анализа биомолекул а также в клинической медицине. С момента его появления в 1987 году метод претерпевал различные модификации и усовершенствования. Сейчас КЭ-МС является одной из наиболее эффективных техник разделения и определения. КЭ-МС активно используется для анализа белков, пептидов, метаболитов и других биомолекул. Однако, разработка онлайн КЭ-МС вызывает множество трудностей и требует детального подхода. В решении проблем при сочетании капиллярного электрофореза с масс-спектрометрией особенно важно понимание принципов капиллярного электрофореза, настройки интерфейса, техники ионизации и системы масс-спектрометрического детектирования.









