Декарбоксилирование

Декарбоксилирование — это реакция элиминирования молекулы диоксида углерода из карбоксильной группы (-COOH) или карбоксилатной (-COOMe) группы органических соединений:
Примеры реакций
Реакция декарбоксилирования обычно протекает при нагревании в присутствии кислот или оснований. Наиболее устойчивы к декарбоксилированию монокарбоновые насыщенные кислоты: реакция протекает только при высоких температурах:
При наличии в α-положении электроотрицательных групп реакция декарбоксилирования облегчается вследствие возникновения циклического переходного состояния, например, для ацетоуксусной кислоты:

По аналогичной схеме отсуществляется декарбоксилирование нитроуксусной кислоты:
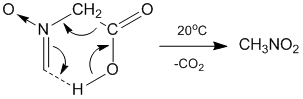
Реакция декарбоксилирования нитроалкановых кислот является одним из препаративных способов синтеза нитроалканов.
Если карбоксильная группа связана с электрофильными группами, то отщепление молекулы диоксида углерода протекает особенно легко, в частности термическое разложение пировиноградной и щавелевой кислот:
Декарбоксилирование дикарбоновых кислот используется для получения циклических кетонов. Например, нагревание адипиновой кислоты с небольшим количеством оксида бария позволяет получать с хорошим выходом циклопентанон:

Декарбоксилирование ароматических кислот протекает в жёстких условиях, в частности, в хинолине в присутствии порошков металлов в качестве катализатора. Так, нагревание пирослизевой кислоты в присутствии порошка меди приводит к фурану:

Наличие в ароматическом кольце электрофильных заместителей также облегчает протекание реакции декарбоксилирования.
Пары карбоновых кислот над нагретым катализатором (CaCO3, BaCO3, Al2O3) превращаются в кетоны:
Реакция Кольбе — декарбоксилирование натриевых солей карбоновых кислот при электролизе их концентрированных растворов:
Реакция декарбоксилирования является ключевой стадией таких реакций, как реакции Симонини, Марквальда, Дейкина-Уэста и Бородина-Хунсдикера.
Окислительное декарбоксилирование
При нагревании до 260—300o С медной соли бензойной кислоты она разлагается с образованием фенилбензоата, диоксида углерода и меди:
[C6H5-C(O)O]2Cu --> C6H5-C(O)O-C6H5 + CO2 + Cu
Реакция протекает через циклическое промежуточное состояние. Одним из вариантов окислительного декарбоксилирования является реакция карбоновых кислот с тетраацетатом свинца (окислитель) в присутствии хлорида кальция или лития (источник хлорид-анионов). Реакция протекает в кипящем бензоле и приводит к образованию галогенпроизводных углеводородов:
R-C(O)-OH + Pb[CH3C(O)O]4 + 2 LiCl --> R-Cl + Pb[CH3C(O)O]2 + CH3C(O)OLi + CH3C(O)OH
Реакции декарбоксилирования являются неотъемлемыми и важнейшими стадиями таких биохимических процессов как спиртовое брожение и цикл трикарбоновых кислот.
Ссылки
- Механизм реакций цикла Кребса (Flash-иллюстрация)
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5.
- О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.
- К. В. Вацуро, Мищенко «Именные реакции в органической химии», М.: Химия, 1976.
- Дж. Дж. Ли, Именные реакции. Механизмы органических реакций, М.: Бином., 2006.

![{\displaystyle {\mathsf {CH_{3}COONa+NaOH{\xrightarrow[{}]{400^{o}C}}CH_{4}+Na_{2}CO_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/998b055a266ea6b2ab6307429d8f5c7261f1962f)


















