Дендритный потенциал действия

А. Изображение клетки Пуркинье в срезах мозжечка.
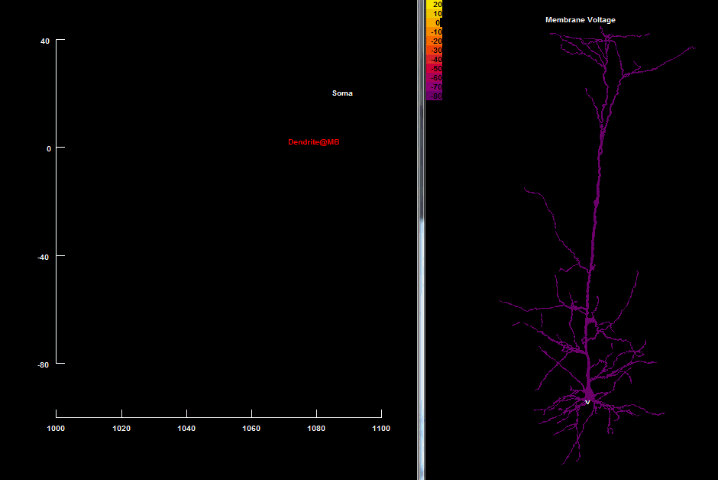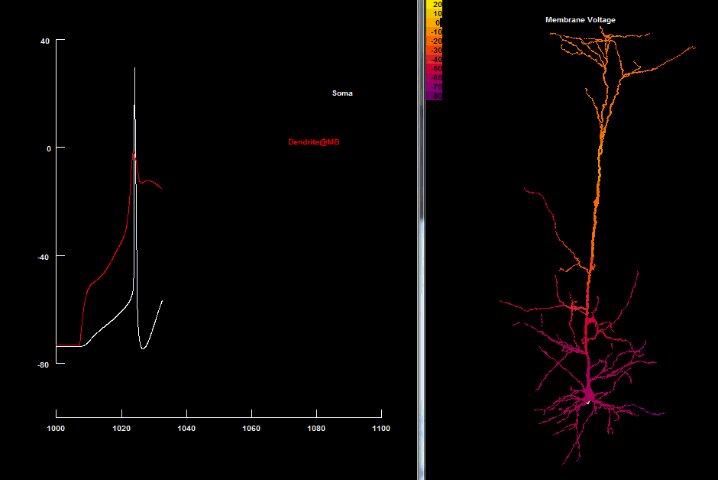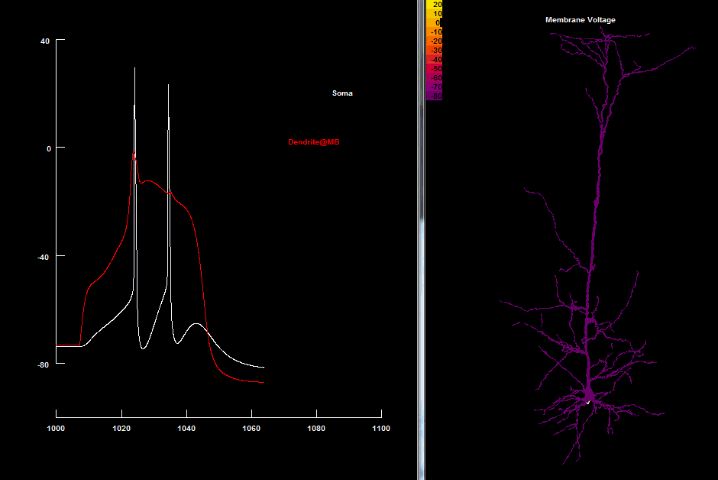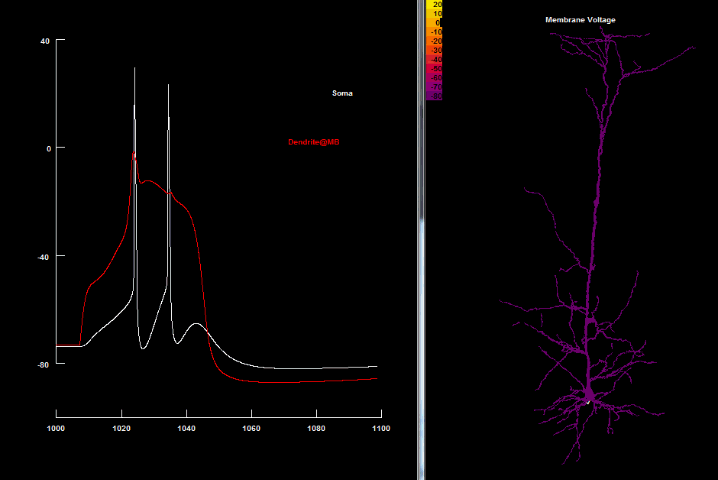
В. Внутриклеточная регистрация потенциала в соме и 3-х разных регионах дендритного дерева показывает быстрое, спонтанное возникновение в аксонном холмике Na+ зависимых спайков. Они пассивно обратно распространяются в дендритное дерево (заметно их быстрое и сильное уменьшение в амплитуде вследствие электротонического убывания).
С-Е. Внутриклеточная регистрация в нескольких более отдалённых регионах дендритного дерева фиксирует Ca2+ спайки. Пассивное распространение этих спайков к аксонному холмику вызывает инактивирующую пачку (англ. burst), которая прерывает соматический разряд.
Хотя долгое время считалось, что потенциал действия (ПД) может генерироваться преимущественно на начальном сегменте низкопорогового нейронного аксона (AIS), в течение последних десятилетий было накоплено много данных в пользу того, что потенциалы действия также возникают в дендритах. Такой дендритный ПД, для того чтобы отличить его от аксонного потенциала действия, часто называют «дендритный спайк».
Дендритные спайки локально генерируются в дендритах многих типов нейронов ЦНС путём фокальной стимуляции дендрита. В общем, несмотря на их несколько смешанную природу, можно чётко различить три главных типа дендритных спайков, согласно классу активных проводников, лежащих в их основе: Na+, Ca2+ (или плато-спайки) и N-метил-D-аспартат (NMDA) спайки. Хотя различные электрические свойства, типы каналов и многообразие дендритной морфологии порождают отличные дендритные ПД, с разным временем нарастания и продолжительностью, дендритные спайки обладают харакатерными для классических (аксонных) ПД свойствами: они имеют порог возбуждения, рефракторный период и активно распространяются на определённое расстояние[2].
Дендритный спайк является нелинейным феноменом, который способен преодолеть влияние других синапсов и предотвратить интеграции дополнительных входных синаптических импульсов, представая как результат локальной суммации синхронизированных кластеров входных сигналов к дендриту. Дендритные спайки обычно гораздо медленнее, чем аксонные ПД, и генерируются или изолированно от сомы (локальные спайки), или совпадая с аксонными потенциалами действия обратного распространения. Если дендритный спайк является достаточно сильным, он может распространиться к телу нейрона (сомы) и привести к генерации сомато-аксонного потенциала действия, или даже пачкам (bursts) потенциалов действия (несколько спайков)[3].
Существование дендритных спайков существенно увеличивает репертуар вычислительных функций нейрона, делая возможным функциональные ассоциации локальных входных сигналов[4]; усиление отдалённых синаптических импульсов, которые в противном случае не могли бы иметь влияние на соматический потенциал[5]; влиять на стимуляцию синаптической пластичности.
История
Хотя в 1950-х и ранних 1960-х господствующим было представление, что дендриты являются пассивными отростками нейронов, которые просто интегрируют возбуждающие и ингибирующие импульсы, накапливались единичные свидетельства, что в дендритах также может распространяться потенциал действия. Впервые зафиксировал его в 1951 году выдающийся китайский нейрофизиолог Сян-Тун Чан (en:Hsiang-Tung Chang), который тогда работал в Йельском университете. В опубликованной в том году статье он сообщил о том, что дендриты могут возбуждаться под воздействием электрической стимуляции и способны генерировать потенциалы действия, которые отличаются от аксонных тем, что не является «всё-или-ничего»[1] потенциалами[6]. В следующих восьми своих публикациях он подтвердил свои находки, однако большинство нейробиологов отнеслись к ним критически, и в дальнейшем считая, что только аксоны являются единственным местом генерации потенциала действия.
Вскоре после Чанга, в результате регистрации популяционных ответов в поле CA1 нейронов гиппокампа, были получены очередные доказательства относительно генерации дендритами спайков. В середине 1950-х нейрофизиологи зафиксировали электрогенный ответ в апикальных дендритах CA1 нейронов, которые предшествовали соматически-аксонному популяционному спайку (PS)[7][8][9][10]. Тогда же Джон Эклс с коллегами обнаружили, что спайк также может генерироваться в дендритах мотонейронов с хроматолизом[11]. В 1961 году, Кендалл и Спенсер в своей классической статье[12] сообщили о внутриклеточной регистрации малого, спайкоподобного потенциала (названного «быстрый препотенциал») в апикальных дендритах CA1 нейронов гиппокампа и впервые сделали предположение, что дендриты могут генерировать спайки. Впоследствии, похожие «дендритные спайки» были обнаружены в мозжечковых клетках Пуркинье[13], а также, — в частности советскими физиологами — в нейронах коры черепах (1976)[14], обонятельной луковице[15] и сенсомоторной коре крыс[16].
Впрочем, лишь с конца 1980-х — начале 1990-х учёные начали постепенно склоняться к мысли, что дендриты не только передают информацию, но и меняют и хранят. Наиболее однозначно существование дендритных спайков было показано в серии статей Грега Стюарта и Берта Закмана в течение 1993—1998 годов[2][17][18], которые использовали цело-клеточные пэтч-электроды для регистрации одновременно соматического потенциала действия и дендритного спайка. Это были первые прямые свидетельства существования потенциалзависимых ионных каналов в дендритах, которые служат для генерации и поддержания потенциалов действия.
Дендритные спайки
Na+ — Ca2+ спайки

А. Генерация ПД в течение синаптической стимуляции с разной интенсивностью в верхнем слое 2/3. Близкая к соме стимуляция (слева) всегда вызывает ПД, который сначала возникает в соме, независимо от того, была стимуляция пороговой или более интенсивной. Однако удалённая синаптическая стимуляция может сместить место начала ПД к апикальному дендриту, особенно во время высокоинтенсивной стимуляции.
B. Генерация ПД имитируемыми ВПСП (возбуждающий постсинаптический потенциал). Вверху: дендритная инжекция тока (4 nA) в течение пороговой интенсивности всегда вызывает ПД сначала в соме. Внизу: Увеличение амплитуды дендритной инжекции тока (6 nA) генерирует дендритные регенеративные потенциалы перед соматическим потенциалом действия. Чётко заметная двухфазность дендритной реакции может означать, что ранняя реакция — это локально порождённый регенеративный потенциал, а поздняя — изменение дендритного напряжения — связана с соматическим ПД обратного распространения.
C. Генерация дендритного электрогенеза в полной и частичной изоляции от соматического ПД. Дендритная регистрация 440 μm от сомы. Вверху: Возникновение дендритного регенеративного потенциала при отсутствии соматических ПД. Внизу: Возникновение дендритного регенеративного потенциала к соматическому ПД. Когда дендритные потенциалы возникают в изоляции от соматических ПД, они настолько сильно слабеют во время распространения к соме, что изменение напряжений в соме в ответ на эти события трудно отличить от того, которое случается, когда удаленная синаптическая стимуляция не в состоянии вызвать дендритный регенеративный потенциал.
D. Кальциевый электрогенез, связанный с обратным распространением потенциалов действия. Дендритная регистрация 325 μm от сомы. Вверху: Соматический и дендритный (толстая линия) потенциалы действия, вызванные пороговой синаптической стимуляцией в слое 2/3 коры. Хорошо видно плечо (*) на нисходящей фазе дендритного потенциала действия, которое было тем больше, чем дальше от сомы осуществлялась регистрация, и было особенно заметным во время пачек (bursts) соматических ПД. Эти результаты иллюстрируют, что активация дендритных потенциал-зависимых кальциевых каналов потенциалами действия обратного распространения вызывает значительное расширение дендритного спайка.
Начиная с 1990-х сообщение о регистрации дендритных спайков в гиппокампальных и неокортикальных нейронах в срезах и in vivo становятся всё более частыми, всё более убеждая, что дендриты способны генерировать регенеративные спайки с помощью потенциал-зависимых натриевых (Na+) и кальциевых (Ca2+) каналов[19][20]. Одновременные соматические и дендритные пэтч-кламп регистрации непосредственно продемонстрировали генерацию дендритных спайков. В пирамидальных нейронах 5 слоя коры и гиппокампа были обнаружены дендритные спайки, которые предшествуют соматическим спайкам и распространяются в обоих типах нейронов через сильные синаптические возбуждения[21]. Также в мозжечковых клетках Пуркинье, интернейронах гиппокампа, митральных клетках обонятельной системы и ганглионарных клетках сетчатки были обнаружены дендритные спайки и отделённые от соматических потенциалы действия.
Одна из возможных причин, почему эти спайки не было видно раньше, заключается в том, что они могут маскироваться соматическими спайками, которые они вызывают. Генерирование в дендритах спайков чаще всего связано с активной проводимостью Ca2+ или Na+ каналов, или их обоих[22][23]. Деполяризация удалённого апикального дендрита приводит к активации Ca2+ проводимостей, которые генерируют Ca2+ спайк[24].
Одним из самых уникальных примеров влияния дендритных Ca2+ спайков на распространение синаптического потенциала и активного влияния на сому являются пирамидальные нейроны 5 слоя коры. Вследствие относительно большой длины апикального дендрита много синапсов находятся настолько далеко от сомы, что при отсутствии какого-либо компенсирующего механизма, они не окажут никакого влияния на соматический потенциал.[25]. Впрочем, не только значительное пассивное затухание, но даже активные (Iр и K+ каналов А-типа) токи способны в этих нейронах привести к существенному ослаблению входного синаптического сигнала[26][27].
Поскольку уникальная морфология дендритов пирамидальных нейронов L5 позволяет им выполнять одни из самых сложных вычислительных функций в ЦНС, то для поддержки такой структуры дендритов и компенсации её негативных эффектов на прохождение сигнала, возле главной точки ветвления апикального дендрита (около 500—600 мкм от сомы) существует дополнительная, рядом с аксонной, зона генерации спайков[28].
Поскольку этот регион дендрита характеризуется достаточно высокой плотностью потенциал-зависимых кальциевых каналов, то считается что дистальное (удалённое) апикальное дендритное дерево может действовать как отдельный центр интеграции синаптических импульсов и генерировать собственный, Ca2+ спайк, таким образом побуждая сому и аксон к порождению потенциала действия[29].
Кальциевый спайк в пирамидальных нейронах 5 слоя является настолько сильным, что будучи активирован, он ведёт к повторяющимся разрядам[3]. Поскольку они генерируют длинные (до 50 мсек in vitro) плато-потенциалы, то длительная деполяризация, которая вследствие этого возникает и распространяется до аксонного начального сегмента, влечёт высокочастотные пачки (bursts) потенциалов действия[30]. Особенно неожиданным было открытие того, что генерирование дендритного Ca2+ спайка порождает больше выходных потенциалов действия в аксоне, чем предпороговый входной импульс к соме[31][32]. Наличие отдалённых дендритных Ca2+ спайков может сразу быть замечено в соме благодаря характерному паттерну пачек 2-4 спайков с частотой 200 Гц[33]. Поэтому, возможно, это служит как средство для сигнализирования соседним нейронам о появлении дендритных спайков, и тогда эти пачки спайков могут быть ключевым механизмом кортикального нейронного кода[34].
В клетках Пуркинье генерация дендритных спайков более проста: поскольку в их дендритах нет Na+ каналов, дендритные потенциалы действия обусловлены Ca2+ каналами, что согласуется с большей шириной (spike width) этих спайков.
В отличие от локально ограниченной зоны для генерации Ca2+ спайков, порождение локального Na+ спайка является возможным для большинства регионов дендритных деревьев пирамидальных клеток[35][36]. Эти дендритные спайки похожи на соматические потенциалы действия, поскольку характеризуются быстрым ростом и короткой продолжительностью, однако их распространение в соме является менее устойчивым и может значительно ослабевать в соме, особенно если они генерируются в тонких дендритах[37].
Несмотря на такое ослабление, Na+ спайки способны увеличивать временную точность выходного сигнала соматического потенциала действия благодаря скорости восходящей фазы деполяризации в соме. Поскольку активация локальных Na+ спайков нуждается в короткой локальной деполяризации с большой амплитудой, то для их порождения нужно только, чтобы множество синхронных входных импульсов активизировались в короткой длине дендрита. Подобная синхронная и кластерная активация синапсов была обнаружена в CA1 пирамидальных нейронах гиппокампа, где высвобождение глутамата на радиальный наклонённый дендрит приводило к генерации Na+ спайков в единственной ветке, делая её единственным интеграционным сегментом и местом стимуляции синаптической пластичности[37].
Хотя почти все исследователи признают сегодня существование этих дендритных спайков, среди них существует расхождение относительно роли и влияния этих спайков на соматически-аксонный потенциал действия. Несколько исследований показало, что Na+ и Ca2+ спайки едва приближаются к соме и аксону, имея малую амплитуду и часто оставаясь в пределах места их возникновения. Тройная регистрация по аксону, соме и апикальному дендриту неокортикального пирамидального нейрона показывает, что аксонный потенциал действия всегда предшествует соматическому потенциалу действия, даже если дендритный спайк предшествует соматическому потенциалу действия[2]. Эти данные означают, что дендритные спайки не слишком надёжно распространяются к соме и аксону и, как следствие, обусловленная дендритными спайками деполяризация, которая достигает сомы, часто является малой. Однако, в некоторых случаях, соматическая деполяризация вследствие сочетания возбуждающего постсинаптического потенциала (ВПСП) и дендритного спайка является достаточно большой для генерации потенциала действия в аксоне, тогда как в др. случаях ВПСП и дендритный спайк вместе обусловливают лишь подпороговую деполяризацию в соме и аксоне, заканчиваясь изолированным дендритным спайком.
В отличие от крупных, «всё-или-ничего»[2] потенциалов действия, которые возникают в аксоне или соме, дендритные спайки варьируются в амплитуде и регулируются недавней нейронной историей синаптической и потенциальной активности. Также, в отличие от аксонного потенциала действия, дендритные спайки кардинально ослабляются во время распространения к соме, часто не приводя к потенциалу действия в аксоне[38]. Несмотря на это отличие от потенциала действия, некоторые исследователи считают, что дендритные спайки следует рассматривать как 1) влиятельные, но не абсолютные решающие факторы генерации потенциала действия в аксоне, 2) как форму активной синаптической интеграции, а конечное место синаптической интеграции признать за аксоном[39].
| Ca2+ спайк[40] |
|---|
 |

A. Везикулы в пресинаптических окончаниях содержат глутамат как нейромедиатор (заполненные треугольники). В состоянии потенциала покоя, канал NMDA-рецепторов блокируется магнием.
B. Когда потенциал действия (AP) прибывает в пресинаптическое окончание, везикула присоединяется к мембране клетки, глутамат входит в синаптическую щель и связывает NMDA и не-NMDA рецепторы на постсинаптической мембране. В состоянии потенциала покоя канал NMDA-рецепторов остаётся заблокированным магнием, тогда как не-NMDA каналы открываются (внизу).
C. Когда мембрана постсинаптического нейрона деполяризуется, то прекращается блокировка магния, и кальциевые ионы входят в клетку.
D. Деполяризация постсинаптической мембраны может быть вызвана обратным распространением потенциала действия (BPAP)[41]
E.Клеточные механизмы зависимой от времени пластичности. Биохимические сигнальные пути для большинства форм STDP (англ. Spike-timing dependent plasticity, рус. Модель пластичности, зависимая от времени спайка). Красным указана деполяризация. Для mGluR-CB1-LTD пресинаптический детектор совпадений показан зелёной стрелкой, а постсинаптический — синей. (mGluR = метаботропный глутамат-рецептор; CB = каннабиноиды; N и A = NMDA- и AMPA-рецепторы; A — астроцит)[42]
NMDA-спайк
Ряд экспериментальных опытов показал, что активные дендриты могут генерировать локальные спайки, когда синаптический входной импульс является достаточно сгруппированным в пространстве и времени (последнее является главным условием для существования детектора совпадений в дендритах). Такие спайки могут быть сгенерированы с помощью любой комбинации потенциалзависимых регенеративных внутренних токов, присутствующих в дендритной мембране. К примеру, ток, обусловленный активацией ионотропного рецептора глутамата — NMDA (N-метил-D-аспартат) рецептора — чрезвычайно потенциалзависим.
Ключевой и необычной биофизической характеристикой NMDA-рецепторов является то, что он пассивен при нормальных потенциалах покоя и не проводит ток, пока мембрана не деполяризуется. Когда рецептор связывается глутаматом, его по́ра открывается, но проводимость канала заблокирована внеклеточными Mg2+ ионами. Деполяризация постсинаптической мембраны выталкивает Mg2+ из канала, позволяя ему проводить смесь Na+, K+ и Ca2+[43]. Поэтому, вследствие потенциал-зависимости Mg2+-блокировки, проводимость NMDA-рецепторов является суперлинейной функцией постсинаптического напряжения в диапазоне потенциалов от спокойствия до −20 мВ[44].
Кинетика Mg2+-блокировки быстрая, поэтому, в отличие от медленно деактивирующегося рецептора, соединение деполяризации с канальным блокатором является достаточно быстрым (суб-мсек), позволяя постсинаптической деполяризации быстро открыть канал за десятки миллисекунд после пресинаптического потенциала действия. Однако, кинетика Mg2+ разблокировки также имеет медленные компоненты, которые взаимодействуют с кинетикой канала способом, зависящим от времени, что ведёт к сужению временного интервала, в пределах которого постсинаптическая деполяризация может повлечь открытие NMDA-канала. Другая важная черта NMDA-рецепторов — это его проницаемость для Ca2+ ионов. Через эти вторичные посредники рецептор соединяет свою активность с ферментами[45]. Благодаря этим уникальным свойствам NMDA-рецепторы играют ключевую роль в синаптичнеской пластичности.

1. Клеточная мембрана
2. Канал, который блокируется магнием Mg2+ (3)
3. Участок блокировки Mg2+
4. Участок связывания галлюциногенов
5. Участок связывания цинка Zn2+
6. Участок связывания агонистов (глутамат) и антагонистов (APV)
7. Участки гликозилирования
8. Участки связывания протонов
9. Участки связывания глицина
10. Участок связывания полиаминов
11. Внеклеточное пространство
12. Внутриклеточное пространство
Недавние исследования продемонстрировали, что синхронные синаптические входные импульсы к одной и той же дендритной ветви 5 слоя пирамидальных нейронов деполяризируют мембрану и создают такую положительную обратную связь, что ток через NMDA-рецепторы деполяризирует мембрану и привлекает ещё больше NMDA-переносимых токов (поддерживаясь активацией дендритных Na+ и Ca2+ каналов)[46]. Этот «всё-или-ничего»[3] феномен называется NMDA-спайк и он имеет значительно большую локальную амплитуду и длительность, чем короткие Na+ спайки, но меньшую амплитуду, чем Ca2+ спайки.
In vitro, NMDA-спайк (или плато-потенциалы) были найдены во всех классах тонких дендритов неокортикальных возбуждающих нейронов и во всех слоях неокортекса[35][47][48], а также в гиппокампальных апикальных пучках[49].
Для большинства регионов на дендритах нужно лишь небольшое число синаптических входных сигналов для генерации NMDA-спайка: ~10 сгруппированных входных импульсов на один шипик[50]. Впрочем, подобная сгруппированность (кластерность) не является необходимым условием NMDA-спайков, поскольку они могут быть сгенерированы даже распределёнными на дендритах синаптическими импульсами[51]. С другой стороны, деполяризация вместе с прошлым (от предыдущих активаций) связыванием глутамата снижает глутаматный порог, делая сочетание NMDA-спайков[52].
Результатом NMDA-спайков является нелинейный ответ на синаптические входные импульсы с шаговым увеличением дендритно-соматической деполяризации, которая приводит к генерации плато-потенциалов, которые длятся от 20 до 100 мс[52]. Эти длительные потенциалы более эффективно распространяются к соме, чем соответствующие подпороговые ВПСП (возбуждающие постсинаптические потенциалы). И хотя NMDA-спайк редко преодолевает порог для генерации соматических Na+ потенциалов действия, он значительно усиливает своей локальной активностью влияние на сому синхронно активированных синаптических входных сигналов в базальных дендритах и тем самым увеличивает электрическую связь между синапсами и сомой[35]. Такая локальная дендритная интеграция синаптических импульсов имеет сигмоидальный нелинейный характер. Таким образом, NMDA-спайк наделяет каждый базальный дендрит способностью выполнять сложную интеграцию входящих синаптических сигналов, результат которой затем передаётся к аксо-соматической точке интеграции для генерации нейронного потенциала действия[50][53].
Поскольку — в отличие от спайков, обусловленных потенциал-зависимыми каналами — потребность в глутамате не позволяет NMDA-спайку распространяться за пределы региона синаптической активации, ограничивая его активность тонкими дендритными ветвями, то он рассматривается как один из дендритных механизмов для выявления совпадения входных импульсов, поступающих в непосредственной временной и/или пространственной близости[53][54].
Поэтому, существование этих каналов и обусловленных ими спайков наделяет нейрон способностью за очень короткое время выявлять совпадение в соседних синаптических входах, что всегда считалось присущим только нейронам слуховой системы[55]. В CA1 пирамидальных нейронах существует похожий локальный механизм выявления совпадений, но он связан с другим потенциал-зависимым током — Na+.
Несмотря на их сложную природу, функциональные последствия NMDA-спайков для корковой обработки информации могут быть различными, в зависимости от региона коры. Будучи локализованными на входе в дендрит, они позволяют выполнять параллельную нелинейную обработку сигналов в базальных дендритах, что качественно отличает их от кальциевых спайков в апикальных дендритах, которые распространяются на несколько микрометров в пределах дендритного дерева[48]. NMDA-спайки могут также обеспечить эффективный механизм для NMDA-зависимой долговременной синаптической потенциации одновременно активированных соседних синапсов без участия потенциалов действия обратного распространения[44]. (См. подробнее NMDA-зависимая дендритная пластичность)
Генерация и распространение дендритных спайков
Хотя дендритные спайки во многом схожи с аксонными, они имеют ряд отличий, которые существенно влияют на дендритную обработку информации. Для иллюстрации этого различия лучше всего подходят пирамидальные нейроны, которые обрабатывают сложную информацию и имеют ряд отличительных особенностей в генерации дендритного спайка. Наиболее детально возникновение и распространение дендритных спайков изучено на примере CA1 пирамидальных нейронов гиппокампа, в частности на удаленном апикальном стволе и проксимальном пучке их дендритов[56].
На примере CA1 нейронов было обнаружено, что порог генерации дендритного спайка на около 10 мВ более деполяризован, чем порог соматического спайка (48 мВ для дендритов по сравнению с 56 мВ для сомы). То есть, порог для генерации потенциала действия в дендритах выше, чем в соме[11][12], что может быть связано с различными свойствами ионных каналов вдоль соматодендритной оси.

Поскольку блокирование Na+ каналов полностью устраняет возможность генерации дендритного спайка, то эти каналы играют важную роль в его генерации. В отличие от дендритов, аксоны имеют несравненно большую плотность Na+ каналов, что снижает порог для активации аксонного потенциала действия в сравнении с дендритным[57][58]. Впрочем, ещё более ключевую роль в различиях между порогами дендритных и соматоаксонных спайков играет увеличение экспрессии в CA1 пирамидальных дендритах K+ каналов А-типа с их удалением от сомы[26]. Следовательно, блокировка IA токов с помощью 4-AP существенно снижает пороговое напряжение для дендритных спайков[56]. Также внутренние выпрямляющие K+ каналы делают значительный вклад во входное сопротивление и поэтому увеличивают количество входных сигналов, которые необходимы для порождения дендритного потенциала действия, хотя они не влияют на пороговое напряжение.
Вследствие относительно высокого порога активации, дендритные спайки генерируются только после значительной, скорой деполяризации (около 20 мВ в пределах <1 мсек). Для этого большое количество синаптических входных импульсов (около 50 синапсов) должно поступить в довольно ограниченный регион (<100 мкм) апикального дендрита в пределах короткого временного интервала (около 3 мсек)[59].
Генерации дендритного спайка также способствуют NMDA-рецепторы, которые противодействуют вызванному АМРА-синаптическими проводимостями шунтированию, что сужает максимальный интервал распространения входных сигналов. NMDA-рецепторы способны расширять пространственно-временные интервалы (кластеризацию сигналов и их различия во времени), необходимые для генерации спайков[54]
Следствием влияния этих факторов является способность спайка, генерируемого в главном дендритном стволе, распространяться к соме для порождения исходного потенциала действия, таким образом существенно повышая эффективность входного импульса, сгенерированного дендритным спайком[56]. Поэтому, сильно синхронизированный входной сигнал приводит, с незначительным краткосрочным опозданием (<2 мсек), к генерации исходного потенциала действия для входных синаптических уровней (количество активированных синапсов), которые значительно меньше, чем тогда, когда распространение дендритного спайка ограничено (напр., ввиду присутствия TTX).
Впрочем, даже все упомянутые условия не гарантируют устойчивого и надёжного распространения дендритных спайков, которые являются достаточно слабыми, чтобы противостоять влиянию других факторов: мембранному потенциалу, расстоянию места генерации от сомы, внеклеточной ионной концентрации и т. д. Именно поэтому в пределах одного (пирамидального) нейрона могут происходить сложные и интересные взаимодействия между различными классами возбуждающих и ингибирующих синапсов, такие, как выявление совпадений, BAC firing, двух- и трёхслойная интеграция входных сигналов и др.
Но даже если дендритные спайки не распространяются к соме, они способны усиливать синаптические потенциалы и увеличивать скорость роста соматического ВПСП, делая выходной спайк более точным и синхронизированным с входным синаптическим импульсом[54].
Обратное распространение потенциала действия
Накопленные за последние десятилетия данные позволили значительно изменить и дополнить нейронную доктрину Рамона-и-Кахаля, поскольку было выявлено, что у многих типов нейронов наличие возбуждающих ионных токов в дендритах позволяет им поддерживать дендритные потенциалы действия, идущие в обратном направлении — от сомы к дендритам — т. н. потенциал действия обратного распространения[4] (англ. back-propagating action potential, bAP). bAP является активным, ретроградным сигналом, который распространяется в дендритное дерево и информирует синапсы, что нейрон сгенерировал исходный потенциал действия.
Существование обратного распространения соматического потенциала является важным механизмом как для взаимосвязи между дендритами и аксонами, так и для эффективного влияния аксонного ПД на дендритный спайк, и наоборот, дендритов на сому и аксоны. Именно благодаря bAP дендритные спайки согласуются с целостной активностью нейрона и делают возможным более точное и надежное влияние синаптических входных сигналов на конечный нейронный импульс.
Проникновение потенциала действия обратного распространения в дендриты не является одинаковым для всех нейронов и даже различается среди дендритов одного и того же самого нейрона. Во многих клетках (пирамидальных, интернейронах гиппокампа, допамин- и ГАМК-поставляемых нейронах чёрной субстанции (substantia nigra), мотонейронах спинного мозга и митральных клетках) потенциал действия активно распространяется обратно в дендриты с малым или почти отсутствующим уменьшением в амплитуде[60][61]. В пирамидальных нейронах bAP проникают не только в апикальные дендриты, но даже в радиальные наклонённые и базальные дендриты, но могут слабеть и уже пассивно распространяться в апикальном пучке. И почти совсем пассивно bAP распространяются в клетках Пуркинье[62].
Поэтому, степень распространения bAP не является одинаковой и варьируется в зависимости от типа нейрона, что в значительной степени обусловливает также и разницу в электрической и вычислительной активности этих нейронов. Поскольку активное обратное распространение потенциала в дендритах усиливается потенциал-зависимыми Na+-каналами, то специфическая для каждого нейрона разница в плотности дендритных Na+ каналов является одной из причин такой вариабельности bAP[35]. В частности, эксперименты и моделирование однозначно показали, что амплитуда bAP существенно уменьшается после блокировки с помощью TTX дендритных Na+ каналов в тех нейронов, которые имеют одинаковую плотность дендритных и соматических Na+ каналов[63]. Тогда как в нейронах с низкой плотностью дендритных Na+ каналов, как в клетках Пуркинье в мозжечке, амплитуда bAP является одинаковой как в присутствии, так и при отсутствии блокатора TTX.[57][64].
Другим фактором, влияющим на степень распространения bAP в дендритах, является морфология и разветвлённость дендритных деревьев различных типов нейронов[65]. В частности, обратное распространение потенциалов действия в пирамидальных нейронах гиппокампа может остановиться в дендритной точке разветвления и не вызвать кальциевого электрогенеза[64] (см. подробнее внизу).

Кроме этого, значительное влияние на диапазон распространения bAP имеет соматический потенциал действия, поскольку, чем более он шире, тем меньше он угасает во время распространения в дендритном дереве. Несмотря на то, что одной из ролей bAP является инициирование дендритного высвобождения нейромедиатора, то не удивительно, что наиболее эффективным является обратное распространение в дендритном дереве дофаминных нейронов чёрной субстанции (средний мозг), поскольку эти клетки характеризуются самым широким соматическим потенциалом среди всех других нейронов, где был зафиксирован bAP, и который, следовательно, позволяет надёжно и быстро высвобождать дофамин. Такую же роль выполняет bAP в митральных клетках обонятельной луковицы, где соматические потенциалы действия также значительно более широкие, чем в других известных нейронах[66].
Важным фактором в эффективном распространении или угасании bAP являются также пассивные электрические свойства дендритных деревьев. К примеру, снижение эффективного мембранного сопротивления вследствие увеличения синаптической активности может привести к постепенному, хоть и умеренному, уменьшению амплитуды потенциала действия обратного распространения[67]. Кроме того, ингибиторные нейроны также могут значительно ослабить bAP и даже подавить кальциевый электрогенез[68].
Подобно тому, как ПД в апикальных дендритах пирамидальных нейронов 5 слоя коры связаны со значительным дендритным электрогенезом Ca2+, то так же было выявлено, что ПД обратного распространения активируют потенциал-зависимые кальциевые каналы, чем обусловливают расширение дендритного спайка. Более того, в течение пачечных разрядов (англ. burst firing) этот кальциевый электрогенез также увеличивает амплитуду потенциалов действия обратного распространения. Дендритные вхождения Ca2+ в течение bAP были обнаружены в нескольких типах нейронов, включая гиппокампальные CA1[69][70], неокортикальные[28] и др. центральные нейроны[2][71].
И хотя в большинстве нейронов обратное распространение потенциала действия значительно ослабевает по мере удаления от сомы, недавние исследования базальных дендритов пирамидальных нейронов 5 слоя продемонстрировали, что высокочастотные пачки (bursts) потенциалов действия могут распространяться в отдаленные базальные дендриты, вызывая регенеративную активацию потенциалзависимых Ca2+ каналов, что ведет к генерации дендритных Ca2+ спайков[72].
Обратное распространение потенциала действия может также взаимодействовать с синаптическими потенциалами. Проводимость, необходимая для генерации потенциала действия, большая, и поэтому порождает существенное снижение мембранного сопротивления, что больше всего локализуется в аксоне и соме. Такое шунтирования значительно уменьшает мембранную временную постоянную в этих регионах нейрона, осуществляя дренаж заряда из мембранной электрической ёмкости. Этим способом потенциалы действия способны уменьшить амплитуду возбуждающих и ингибирующих постсинаптических потенциалов, тем самым обеспечивая механизм для прекращения интеграции, которая имеет место в дендритах. В неокортикальных пирамидальных нейронах 5 слоя соматические ВПСП, генерируемые базальными входными импульсами, могут быть ослаблены до 80 % единственным потенциалом действия. С другой стороны, более отдалённые входные импульсы апикальных дендритов менее шунтируются, поскольку они находятся значительно дальше от изменения проводимости, возникшей в течение потенциала действия[73].
Обратная связь, которая осуществляется через такое обратное распространение потенциала действия, является достаточно сложной и имеет множество важных последствий для функционирования дендритов, как и для синаптической пластичности. К примеру, единственный bAP способен активировать слабые дендритные потенциал-зависимые токи, которые, в свою очередь, протекают назад, в сторону начального сегмента генерации потенциала действия в аксоне, часто приводя к генерации дополнительного потенциала действия. Таким образом, в результате взаимодействия с дендритами, соматический ПД способен приводить к генерации даже пачек потенциалов(см. следующий подраздел)[40][74].
Также bAP может служить как ассоциативная связь между пресинаптическим возбуждением и постсинаптической активностью нейрона, приводя к усилению/ослаблению отдельных синаптических контактов между нейронами. К примеру, зависимые от активации NMDA-рецептора изменения в синаптической силе прямо зависят от обратного соматического потенциала: bAP ослабляет потенциал-зависимая Mg2+ блокировка NMDA-рецепторов, что приводит к увеличению вхождения Ca2+ через активированные рецептором каналы и, как следствие, к изменению в синаптической силы на дендритах. Симптоматичным в этом отношении является то, что мозжечковые клетки Пуркинье, в которых отсутствует обратное распространение ПД, также не имеют функциональных NMDA-рецепторов[75].
Другим следствием проникновения bAP в дендритное дерево является увеличение внутриклеточной концентрации дендритного кальция [Ca2+] в результате активации потенциал-зависимых Ca2+ каналов[76]. Это увеличение в [Ca2+] линейно коррелирует со средней частотой разряда соматического ПД в неокортикальных пирамидальных клетках. Также было выявлено, что bAP эффективно распространяются к дендритным шипикам, приводя в них к увеличению внутриклеточного [Ca2+][77]. Кроме роли Ca2+ в синаптической пластичности (см. подробнее Дендритная пластичность), рост внутриклеточной концентрации кальция влияет также на синаптическую интеграцию через подавление опосредованных NMDA-рецептором ответов или через активацию дендритных K+ проводимостей, которые могут шунтировать часть дендритного дерева[78].
И наоборот, bAP могут временно прекратить синаптическую интеграцию из-за возвращения дендритного мембранного потенциала в исходное положение или из-за фиксации возбуждающих синаптических проводимостей близко к их потенциалу реверсии. В нейронах без bAP или где bAP не способны успешно распространяться в отдалённые дендриты, локальные дендритные спайки, которые возникают в этих дендритных регионах, могут генерировать и поддерживать синаптическую интеграцию, которая потом даже будет обратно влиять на соматический потенциал действия[33].
В целом, существование потенциалов действия обратного распространения существенно дополняет и даже меняет классические представления о нейроне. Хотя роль аксона как места окончательной интеграции входных сигналов сохраняется, он теперь имеет не только одностороннее влияние на другие нейроны, но и на свой собственный нейрон, корректируя его активность. Вместе с тем, благодаря bAP, аксон может влиять на интегративные процессы в дендритах и в свою очередь сам ими определяться и существенно изменяя соответственно с ними конечный нейронный сигнал. Как следствие, в ЦНС возникает уникальное взаимодействие между возбуждающими и ингибирующими нейронами. Поскольку большинство ингибиторных синапсов формируют контакты ближе к соме, а некоторые даже на самом начальном сегменте аксона, то это позволяет им наиболее эффективно и точно подавить всю интегративную активность нейрона, исключая сигнализирование интегрированной им информации. Недавнее открытие того, что нейронный транскрипционный фактор регуляции активности NPAS4 (Neuronal Per Arnt Sim domain protein 4) способен увеличивать количество ингибиторных синапсов в соме и уменьшать их количество в дендритах во время поведенческой активности, подтверждает, что подавление соматического bAP хотя и не позволяет дендритам эффективно повлиять на другие нейроны, однако, он делает возможным формирование дендритной пластичности[79]. Поскольку избирательное ингибирование соматического обратного потенциала и ослабление ингибирования дендритного сегмента приведёт к синаптическому усилению этих дендритов. Кроме того, ингибирование сомы гарантирует надёжную и целостную интеграцию в дендритах входной синаптической информации, которая не будет подавлена bAP и успешно потенцирует данный дендритный сегмент или ветку. Поэтому, для следующей генерации целостного нейронного потенциала действия в аксоне достаточно будет нескольких точно направленных синаптических импульсов[80].
Итак, обратное распространение соматического потенциала действия имеет множество фундаментальных последствий как для дендритов, так и для нейрона в целом, поскольку единичные нейроны, имея такие сложные внутренние механизмы обратной связи, больше не могут рассматриваться как разомкнутый контур (en:open-loop)[70][81]. Следовательно, понятие «обратная связь» из нейронных сетей можно перенести на один нейрон, наделяя им каждый элемент сети[82][83].
| Обратно распространяющийся потенциал действия[40] |
|---|
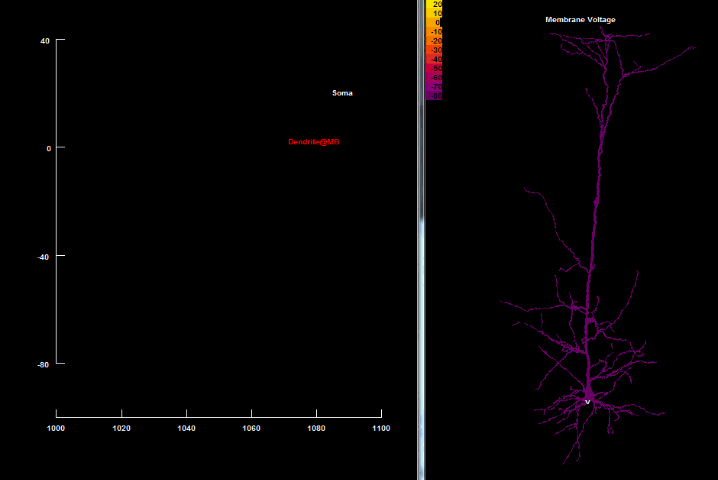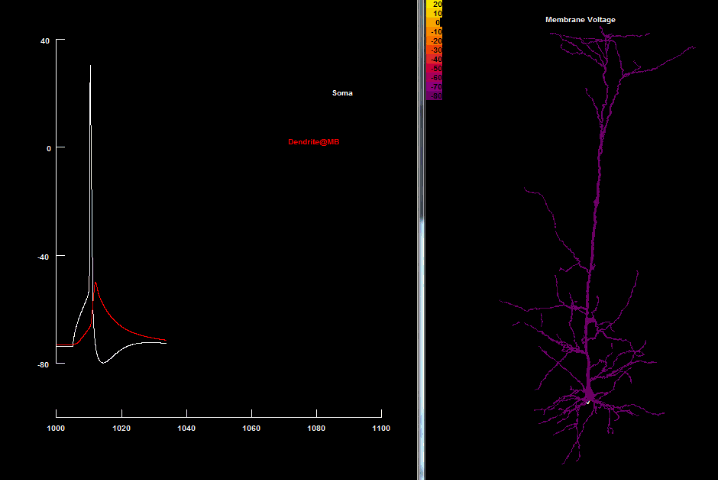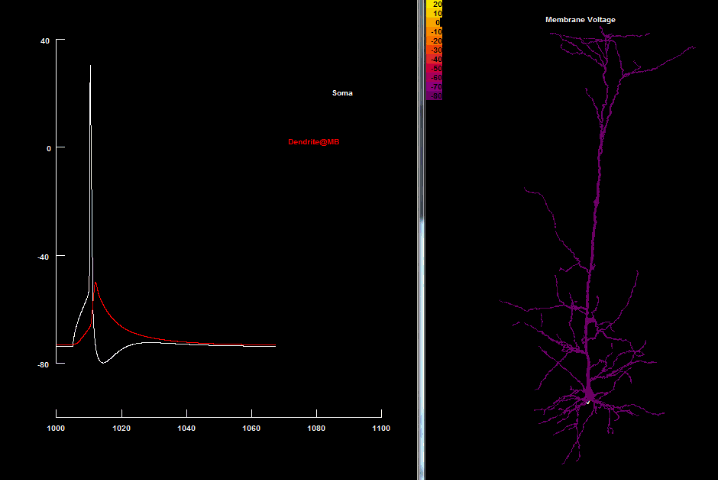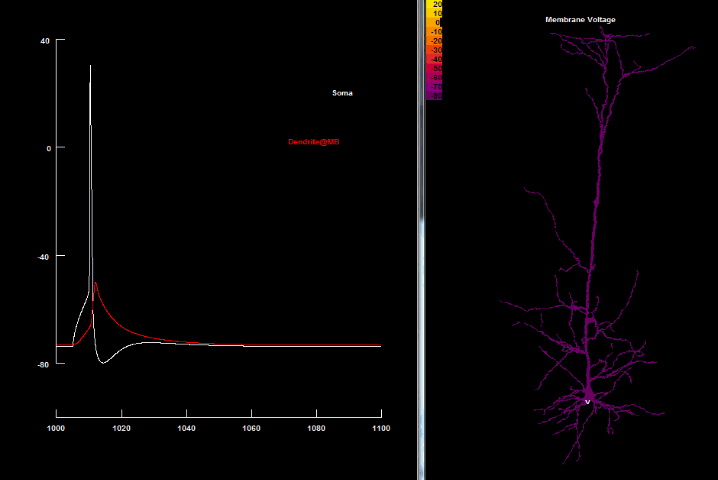 |
BAC firing

Несмотря на открытие Ca2+ спайков, остаётся проблема, как отдалённые синаптические импульсы могут преодолеть порог для генерации таких спайков, поскольку даже импульс, поданный непосредственно на дендритный пучок, имеет незначительное влияние на апикальный Ca2+ начальный сегмент[84]. Важный шаг в решении этой проблемы был сделан с открытием того, что Na+ и Ca2+ начальные сегменты в пирамидальных клетках 5 слоя коры способны влиять друг на друга через апикальный дендрит, который усеян Na+ потенциалзависимыми каналами, способными поддерживать распространение сигнала[32] Это означало, что даже если малые (подпороговые) сигналы делают небольшой вклад только в свой начальный сегмент, достигая локального порога, то это быстро сигнализируется в другой начальный сегмент. Вполне естественно, что возникает возможность для появления ассоциативных взаимосвязей даже в пределах единого (пирамидального) нейрона, благодаря чему активность одного региона клетки может снизить порог для инициирования активности в другом регионе[50].
Одновременное совпадение удалённых входящих синаптических импульсов в дендритах с аксонным потенциалом действия обратного распространения в пределах соответствующего временного интервала (20-30 мс) сокращает порог для генерации дендритного Ca2+ спайка и, как следствие, может привести к порождению пачки множественных потенциалов действия в соме[24][33]. Для такого совпадения потенциалов сомы и дендрита создали отдельный термин — «активированный обратным распространением потенциала действия Са2+ спаечный разряд» (англ. Backpropagation - activated Ca2+ spike firing, BAC firing)[24].
В основе генерации пачек потенциалов действия лежит тот факт, что дендритный Ca2+-спайк может повлечь достаточно деполяризации в аксонной начальной зоне для прохождения порога возбуждения, в результате чего возникают сложные дендритные потенциалы. В свою очередь, потенциалы действия обратного распространения существенно уменьшают порог для генерации этого дендритного Ca2+-спайка. Как следствие этих событий, генерируется пачка аксонных потенциалов действия, которые передаются обратно в дендритную ветвь[24].
Итак, после сочетания bAP и подпорогового ВПСП, конечная форма нейронного импульса будет состоять из 1) первого аксонного потенциала и 2) второго и третьего ПД, связанных с дендритными спайками. Такой сложный механизм и характеризует «BAC firing», необходимость временной синхронности которого соответствует такой же временной точности STDP-пластичности на отдалённых синапсах.
Другой характерной чертой «BAC firing» является то, что он может быть блокирован точно синхронизированной активацией направленного в нейрон ингибиторного входного импульса, который длится ~400 мс. Это означает, что ингибирование может использоваться в коре как для контроля соединений между зонами генерации близких и отдалённых спайков, так и для того, чтобы подавлять пачечные разряды, связанные с «BAC firing»[68].
В отличие от обычной нейронной сети, уникальное строение пирамидального нейрона коры 5 слоя позволяет его индивидуальным единицам обрабатывать два потока информации отдельно и затем объединить их, используя только внутренние свойства клетки, таким образом уменьшая нагрузку на сложность сети нейронов. Поэтому, как следствие особой формы и направленности пирамидальных нейронов 5 слоя коры, в сочетании с уникальной организацией коры, механизм «BAC firing» идеально подходит для ассоциирования в пределах нескольких миллисекунд корковых путей прямой (feed-forward) и обратной (feedback) связи в пределах одного нейрона, то есть сочетание восходящей («bottom-up») сенсорной информации с нисходящими («top-down») ассоциативными сигналами[85].

Учитывая подобную сложность пирамидальных нейронов и уникальность их дендритов, Мэтью Ларкум (англ. Matthew Larkum), который открыл «BAC firing» и ряд других ключевых свойств дендритов, выдвинул гипотезу, что для существования в коре головного мозга ассоциирования внешних данных о мире с его внутренними репрезентациями не обязательно нужны громоздкие нейронные сети и их сложные механизмы самоорганизации, — это может быть реализовано на клеточном уровне и через внутриклеточные механизмы[34][85]. Это позволяет коре выполнять те же самые операции, но с несравненно более мощными параллельными вычислениями, чем искусственные нейронные сети и их аналоги.
В коре, соматические и проксимальные входные сигналы к пирамидальным нейронам 5 слоя поступают из восходящих, специфических сенсорных регионов, тогда как отдалённые апикальные дендриты этих клеток получают нисходящую информацию или от других сенсорных центров, или же от высших слоев коры, в частности центров внимания. С другой стороны, механизм «BAC-firing» связан с отдельным, новым типом нейронного кода — т. н. «burst-timing code», который отличается от классических нейронных кодов («rate code» и «spike-timing code»)[86]. Поскольку входные сигналы к соме и дендритам пирамидального нейрона L5 происходят из разных регионов коры, то «burst-timing код» позволяет выявить совпадение этих восходящих и нисходящих сигналов и сигнализировать его нижестоящим постсинаптическим нейронам.
Опираясь на эти факты, модель Ларкума постулирует, что информация, которая поступает из внешнего мира, через прямую связь (feed-forward) поступает в пирамидальные нейроны коры для установки базовой частоты спаечных разрядов (firing), которые в дальнейшем начинают взаимодействовать через обратную связь (feedback) с информацией внутреннего, нейронного происхождения, которая поступает в дендриты этих нейронов и кардинально меняет спаечные разряды нейрона. Обратная связь по этой схеме служит как «предсказание» корой, может ли и должен ли настоящий пирамидальный нейрон (или микроколонки пирамидальных нейронов) генерировать спаечные разряды[85].
Следовательно, ассоциативная функция коры (связывание внешних данных с внутренней картиной мира) теоретически может быть достигнута без необходимости сложных схем, используя единственный, двухмерный слой расположенных вертикально в одну линию пирамидальных нейронов. Таким способом также может быть решена классическая нейронная проблема гомункула — отдельного механизма или структуры, который следит за нейронной информацией, ассоциирует и осмысливает её. Согласно модели Ларкума, нейроны, которые лучше всего соответствуют предсказательным обратным связям, имеют большее влияние на другие части мозга из-за увеличения их спаечных разрядов или пачек. В свою очередь, их активность через прямую связь будет влиять на дальнейшее совершенствование предсказательной силы обратных связей и т. д. С другой стороны, временная зависимость, свойственная «BAC firing», может быть одним из ключевых механизмов для увеличения синхронизации входных импульсов и служить для увеличения нейронами синхронности их выходных сигналов[34].
| Кальциевый спайк, который активируется потенциалом действия обратного распространения (BAC firing)[40] |
|---|
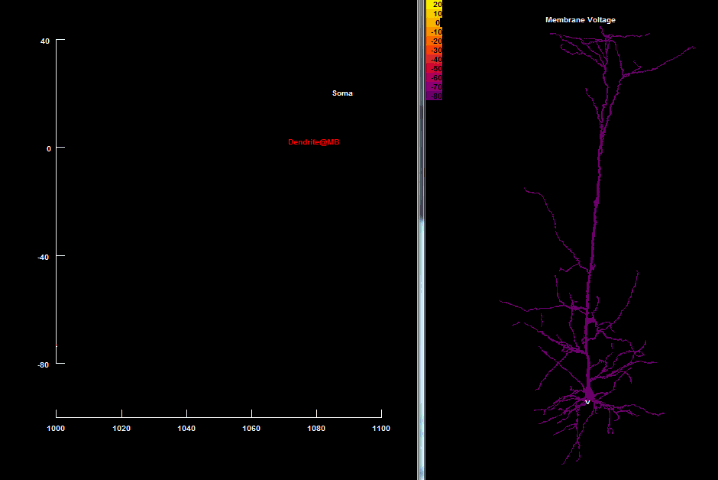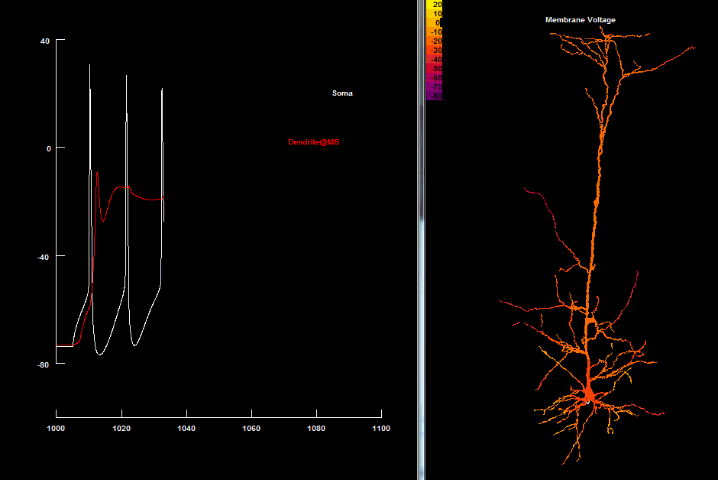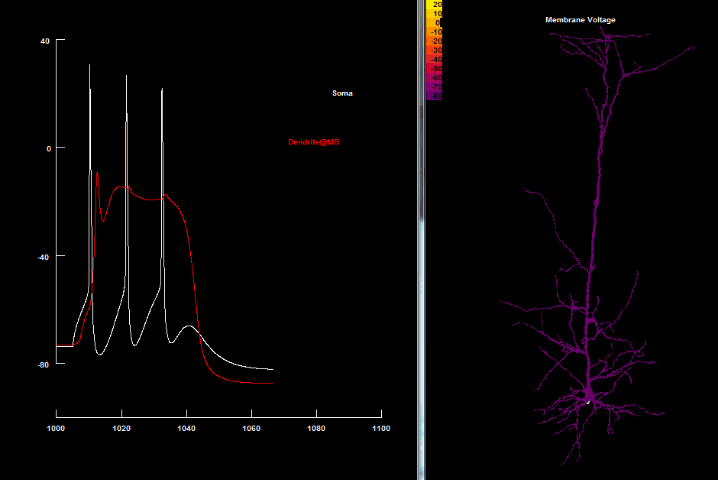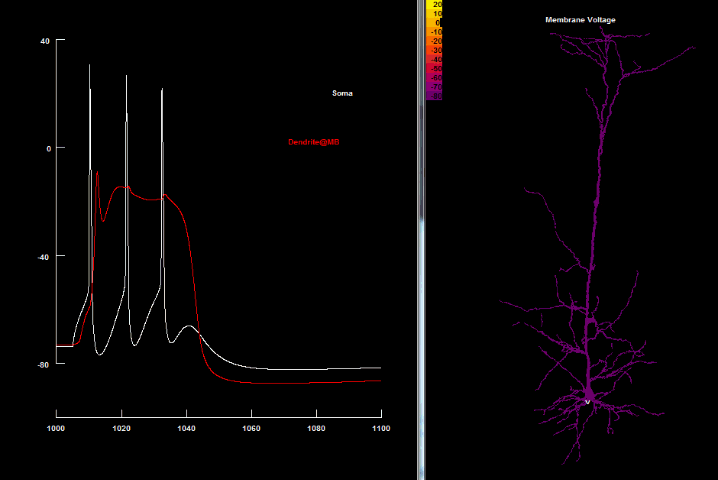 |
Открытие того, что дендриты могут генерировать спайки, породило важную проблему — как дендриты интегрируют синаптические импульсы: если спайки могут быть сгенерированы в дендритах, интегративная сила дендритного дерева будет минимальной, поскольку многие пространственные и темпоральные взаимодействия, включая возбуждения и торможения, будут нивелированы генерацией дендритного спайка в ответ на несколько ВПСП (возбуждающий постсинаптический потенциал). Одно из решений было предложено ещё в 1959 году выдающимся американским нейрофизиологом Рафаэлем Лоренте де Но (en:Rafael Lorente de Nó), который выдвинул предположение[87], — которое сегодня подтверждается многими экспериментальными данными[24][88] — что уменьшение проводимости дендритных спайков может играть важную роль в дендритной интеграции в ЦНС. В связи с этой идеей, спайки могут быть сгенерированы в дендритах, но они не будут благополучно распространяться к соме. Их главное воздействие будет заключаться в увеличении деполяризации, связанной с данным синаптическим импульсом, но не обязательно в генерации аксонного потенциала действия[89]. Одна из главных функций такого спайка будет заключаться в усилении синаптических потенциалов, благодаря чему будет увеличиваться вероятность, что комбинация синапсов, которые вызвали настоящий дендритный спайк, в конце концов приведёт к появлению конечного выходного импульса от нейрона через генерацию потенциала действия в аксоне. В таком случае дополнительная соматическая деполяризация, связанная с дендритным спайком, приведёт мембранный потенциал выше порога для генерации соматически-аксонного потенциала действия[90].
Примечания
- 1) ↑ Всё-или-ничего — потенциал, который, будучи сгенерирован (после достижения порога возбуждения), распространяется сам по себе до завершения.
- 2) ↑ Интересно, что «обратное распространение» (en:backpropagation) было предложено в теории искусственных нейронных сетей ещё до его открытия в нейронах как один из методов нейронного обучения (см. метод обратного распространения ошибки). Подобно обучению перцептрона, биологическое обратное распространение также способствует обучению, усиливая или ослабляя синаптическую пластичность. Однако, в отличие от перцептрона, обратное распространение потенциала действия происходит в пределах одного нейрона и благодаря существованию дендритных локальных спайков может быть вполне независимым от пост- и пресинаптических нейронов, наделяя один нейрон свойствами целой нейронной сети.
Источники
- ↑ Llinás R. and Sugimori M. Electrophysiological properties of in vitro Purkinje cell dendrites in mammalian cerebellar slices (англ.) // The Journal of Physiology[англ.] : journal. — 1980. — 1 August (vol. 305). — P. 197—213. — PMID 7441553. Архивировано 11 октября 2017 года.
- ↑ 1 2 3 4 5 Stuart G., Schiller J., and Sakmann B. Action potential initiation and propagation in rat neocortical pyramidal neurons (англ.) // The Journal of Physiology[англ.] : journal. — 1997. — 15 December (vol. 505, no. 3). — P. 617 — 632. — PMID 9457640. Архивировано 22 августа 2018 года.
- ↑ 1 2 Larkum M. E. and Zhu J.J. Signaling of Layer 1 and Whisker-Evoked Ca2+ and Na+ Action Potentials in Distal and Terminal Dendrites of Rat Neocortical Pyramidal Neurons In Vitro and In Vivo (англ.) // The Journal of Neuroscience[англ.] : journal. — 2002. — 15 August (vol. 22, no. 16). — P. 6991—7005. Архивировано 5 февраля 2015 года.
- ↑ Mel Bartlett W. Information Processing in Dendritic Trees (англ.) // Neural Computation[англ.]. — 1994. — Vol. 6, no. 6. — P. 1031—1085. — ISSN 0899-7667. — doi:10.1162/neco.1994.6.6.1031.
- ↑ Larkum Matthew E and Nevian Thomas. Synaptic clustering by dendritic signalling mechanisms (англ.) // Current Opinion in Neurobiology : journal. — Elsevier, 2008. — Vol. 18, no. 3. — P. 321—331. — ISSN 09594388. — doi:10.1016/j.conb.2008.08.013.
- ↑ Chang Hsiang-Tung. Dendritic potential of cortical neurons produced by direct electrical stimulation of the cerebral cortex (англ.) // Journal of neurophysiology[англ.] : journal. — 1951. — 1 January. — P. 1 1—21. Архивировано 23 декабря 2015 года.
- ↑ Cragg B. G. and Hamlyn L. H. Action potentials of the pyramidal neurones in the hippocampus of the rabbit (англ.) // The Journal of Physiology[англ.] : journal. — 1955. — 28 September (vol. 129). — P. 608—627 PMCID = PMC1365988.
- ↑ Fujita Yasuichiro and Sakata Hideo. Electrophysiological properties of CA1 and CA2 apical dendrites of rabbit hippocampus (англ.) // Journal of Neurophysiology[англ.] : journal. — 1962. — Vol. 25. — P. 209—222.
- ↑ Herreras O. Propagating dendritic action potential mediates synaptic transmission in CA1 pyramidal cells in situ (англ.) // Journal of neurophysiology[англ.] : journal. — 1990. — 1 November (vol. 64). — P. 1429—1441.
- ↑ Wall P. D. Impulses originating in the region of dendrites (неопр.) // The Journal of Physiology,. — 1965. — 1 September (т. 180). — С. 116—133. (недоступная ссылка)
- ↑ 1 2 Eccles J. C., Libet B., Young R. R. The behaviour of chromatolyzed motoneurons studied by intracellular recording (англ.) // Journal of Physiology[англ.] : journal. — 1958. — Vol. 143. — P. 11—40.
- ↑ 1 2 Spencer and E.Kandel. Electrophysiology of hippocampal neurons: IV. FAST PREPOTENTIALS (англ.) // Journal of neurophysiology[англ.] : journal. — 1961. — 1 May (vol. 24). — P. 272—285. Архивировано 16 февраля 2015 года.
- ↑ Llinas R. and Nicholson C.; Precht, W. Preferred Centripetal Conduction of Dendritic Spikes in Alligator Purkinje Cells (англ.) // Science : journal. — 1969. — Vol. 163, no. 3863. — P. 184—187. — ISSN 0036-8075. — doi:10.1126/science.163.3863.184.
- ↑ Pivovarov A. S. Action potential generation by turtle cortical neurons. Dendritic and somatic spikes (англ.) // Neurophysiology : journal. — 1977. — Vol. 8, no. 3. — P. 181—186. — ISSN 0090-2977. — doi:10.1007/BF01064613.
- ↑ Voronkov G. S., Gusel'nikova K. G. and Torgovanova G. V. Generation of spike activity by dendrites of secondary neurons of the rat olfactory bulb (англ.) // Neurophysiology : journal. — 1977. — Vol. 8, no. 3. — P. 218—224. — ISSN 0090-2977. — doi:10.1007/BF01064619.
- ↑ Labakhua T. Sh., Kokaya M. G. and Okudzhava V. M. Dendritic action potentials of pyramidal tract neurons in the cat sensorimotor cortex (англ.) // Neurophysiology : journal. — 1986. — Vol. 18, no. 4. — P. 307—314. — ISSN 0090-2977. — doi:10.1007/BF01052798.
- ↑ Stuart Greg J.and Sakmann Bert. Active propagation of somatic action potentials into neocortical pyramidal cell dendrites (англ.) // Nature. — 1994. — Vol. 367, no. 6458. — P. 69—72. — ISSN 0028-0836. — doi:10.1038/367069a0.
- ↑ Hausser Michael, Stuart Greg, Racca Claudia and Sakmann Bert. Axonal initiation and active dendritic propagation of action potentials in substantia nigra neurons (англ.) // Neuron[англ.] : journal. — Cell Press, 1995. — Vol. 15, no. 3. — P. 637—647. — ISSN 08966273. — doi:10.1016/0896-6273(95)90152-3.
- ↑ Wong R.K.S., D.A.Prince and Basbaum A.I. Intradendritic recordings from hippocampal neurons (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1979. — February (vol. 76). — P. 986—990. Архивировано 24 сентября 2015 года.
- ↑ Kamondi Anita, Acsády László, Wang Xiao-Jing, Buzsáki György. Theta oscillations in somata and dendrites of hippocampal pyramidal cells in vivo: Activity-dependent phase-precession of action potentials (англ.) // Hippocampus : journal. — 1998. — Vol. 8, no. 3. — P. 244—261. — ISSN 10509631. — doi:10.1002/(SICI)1098-1063(1998)8:3<244::AID-HIPO7>3.0.CO;2-J.
- ↑ Golding NL , Jung H , Mickus T and Spruston N. Dendritic Calcium Spike Initiation and Repolarization Are Controlled by Distinct Potassium Channel Subtypes in CA1 Pyramidal Neurons (англ.) // The Journal of Neuroscience[англ.] : journal. — 1999. — 15 October. — P. 8789—8798. Архивировано 19 декабря 2015 года.
- ↑ Oesch Nicholas, Euler Thomas, Taylor W. Rowland. Direction-Selective Dendritic Action Potentials in Rabbit Retina (англ.) // Neuron[англ.] : journal. — Cell Press, 2005. — Vol. 47, no. 5. — P. 739—750. — ISSN 08966273. — doi:10.1016/j.neuron.2005.06.036.
- ↑ Xiong Wenhui, Chen Wei R. Dynamic Gating of Spike Propagation in the Mitral Cell Lateral Dendrites (англ.) // Neuron[англ.] : journal. — Cell Press, 2002. — Vol. 34, no. 1. — P. 115—126. — ISSN 08966273. — doi:10.1016/S0896-6273(02)00628-1.
- ↑ 1 2 3 4 5 Larkum Matthew E., Zhu J. Julius, and Sakmann Bert. A new cellular mechanism for coupling inputs arriving at different cortical layers (англ.) // Nature : journal. — 1999. — Vol. 398, no. 6725. — P. 338—341. — ISSN 00280836. — doi:10.1038/18686.
- ↑ Stuart G and Spruston N. Determinants of voltage attenuation in neocortical pyramidal neuron dendrites (англ.) // The Journal of Neuroscience[англ.] : journal. — 1998. — 15 May (vol. 18). — P. 3501—3510. — PMID 9570781. Архивировано 10 ноября 2016 года.
- ↑ 1 2 Hoffman DA , Magee JC , Colbert CM , Johnston D. K+ channel regulation of signal propagation in dendrites of hippocampal pyramidal neurons (англ.) // Nature : journal. — 1997. — 26 June (vol. 387). — P. 869 — 875. Архивировано 15 октября 2013 года.
- ↑ Magee Jeffrey, Hoffman Dax, Colbert Costa, and Johnston Daniel. Electrical and calcium signaling in dendrites of hippocampal pyramidal neurons (англ.) // Annual Review of Physiology. — 1998. — Vol. 60, no. 1. — P. 327—346. — ISSN 0066-4278. — doi:10.1146/annurev.physiol.60.1.327.
- ↑ 1 2 Schiller Jackie, Schiller Yitzhak, Stuart Greg, and Sakmann Bert. Calcium action potentials restricted to distal apical dendrites of rat neocortical pyramidal neurons (англ.) // The Journal of Physiology[англ.] : journal. — 1997. — Vol. 505, no. 3. — P. 605—616. — ISSN 0022-3751. — doi:10.1111/j.1469-7793.1997.605ba.x.
- ↑ Williams SR. Spatial compartmentalization and functional impact of conductance in pyramidal neurons (англ.) // Nature Neuroscience : journal. — 2004. — 22 August (vol. 7). — P. 961 — 967. — doi:10.1038/nn1305.
- ↑ Schwindt Peter and Crill Wayne. Mechanisms Underlying Burst and Regular Spiking Evoked by Dendritic Depolarization in Layer 5 Cortical Pyramidal Neurons (англ.) // Journal of neurophysiology[англ.] : journal. — 1999. — 1 March (vol. 81, no. 3). — P. 1341—1354. — PMID 10085360. Архивировано 8 ноября 2013 года.
- ↑ Williams Stephen R. and Stuart Greg J. Mechanisms and consequences of action potential burst firing in rat neocortical pyramidal neurons (англ.) // The Journal of Physiology[англ.] : journal. — 1999. — Vol. 521, no. 2. — P. 467—482. — ISSN 0022-3751. — doi:10.1111/j.1469-7793.1999.00467.x.
- ↑ 1 2 Larkum M. E., Senn W. and Lüscher H.-R. Top-down Dendritic Input Increases the Gain of Layer 5 Pyramidal Neurons (англ.) // Cerebral Cortex : journal. — 2004. — Vol. 14, no. 10. — P. 1059—1070. — ISSN 1460-2199. — doi:10.1093/cercor/bhh065.
- ↑ 1 2 3 Larkum M.E., Zhu J.J., and Sakmann B. Dendritic mechanisms underlying the coupling of the dendritic with the axonal action potential initiation zone of adult rat layer 5 pyramidal neurons (англ.) // The Journal of Physiology[англ.] : journal. — 2001. — Vol. 533, no. 2. — P. 447—466. — ISSN 0022-3751. — doi:10.1111/j.1469-7793.2001.0447a.x.
- ↑ 1 2 3 Larkum Matthew. A cellular mechanism for cortical associations: an organizing principle for the cerebral cortex (англ.) // Trends in Neurosciences[англ.] : journal. — Cell Press, 2013. — Vol. 36, no. 3. — P. 141—151. — ISSN 01662236. — doi:10.1016/j.tins.2012.11.006.
- ↑ 1 2 3 4 Nevian T., Larkum M. E., Polsky A., and Schiller J. Properties of basal dendrites of layer 5 pyramidal neurons: a direct patch-clamp recording study (англ.) // Nature Neuroscience : journal. — 2007. — 7 January (no. 2). — P. 206 — 214. — doi:10.1038/nn1826. — PMID 17206140. Архивировано 6 апреля 2010 года.
- ↑ Gasparini S. On the Initiation and Propagation of Dendritic Spikes in CA1 Pyramidal Neurons (англ.) // Journal of Neuroscience[англ.] : journal. — 2004. — Vol. 24, no. 49. — P. 11046—11056. — ISSN 0270-6474. — doi:10.1523/JNEUROSCI.2520-04.2004.
- ↑ 1 2 Losonczy Attila and Magee Jeffrey C. Integrative Properties of Radial Oblique Dendrites in Hippocampal CA1 Pyramidal Neurons (англ.) // Neuron[англ.] : journal. — Cell Press, 2006. — Vol. 50, no. 2. — P. 291—307. — ISSN 08966273. — doi:10.1016/j.neuron.2006.03.016.
- ↑ Golding Nace L and Spruston Nelson. Dendritic Sodium Spikes Are Variable Triggers of Axonal Action Potentials in Hippocampal CA1 Pyramidal Neurons (англ.) // Neuron[англ.] : journal. — Cell Press, 1998. — Vol. 21, no. 5. — P. 1189—1200. — ISSN 08966273. — doi:10.1016/S0896-6273(00)80635-2.
- ↑ Spruston N., Stuart G and Hausser M. Dendritic integration // Dendrites (англ.) / Stuart G., Spruston N., Hausser M.. — Oxford University Press, 1999. — P. 351—401. — ISBN ISBN 0198566565..
- ↑ 1 2 3 4 Schaefer A. T., Larkum ME , Sakmann B , and Roth A. Coincidence Detection in Pyramidal Neurons Is Tuned by Their Dendritic Branching Pattern (англ.) // Journal of Neurophysiology[англ.] : journal. — 2003. — Vol. 89, no. 6. — P. 3143—3154. — ISSN 0022-3077. — doi:10.1152/jn.00046.2003.
- ↑ Gerstner Wulfram and Kistler Werner M. Spiking Neuron Models: Single Neurons, Populations, Plasticity (англ.). — Cambridge University Press, 2002. — P. 480. — ISBN 9780521890793.
- ↑ Feldman Daniel E. The Spike-Timing Dependence of Plasticity (англ.) // Neuron[англ.]. — Cell Press, 2012. — Vol. 75, no. 4. — P. 556—571. — ISSN 08966273. — doi:10.1016/j.neuron.2012.08.001.
- ↑ Gulledge Allan T., Kampa Björn M. and Stuart Greg J. Synaptic integration in dendritic trees (англ.) // Journal of Neurobiology[англ.] : journal. — 2005. — Vol. 64, no. 1. — P. 75—90. — ISSN 0022-3034. — doi:10.1002/neu.20144.
- ↑ 1 2 Hunt David L and Castillo Pablo E. Synaptic plasticity of NMDA receptors: mechanisms and functional implications (англ.) // Current Opinion in Neurobiology : journal. — Elsevier, 2012. — Vol. 22, no. 3. — P. 496—508. — ISSN 09594388. — doi:10.1016/j.conb.2012.01.007.
- ↑ Kampa B. M., Clements J.,Jonas P. and Stuart G. J. Kinetics of Mg2+ unblock of NMDA receptors: implications for spike-timing dependent synaptic plasticity (англ.) // The Journal of Physiology[англ.] : journal. — 2004. — Vol. 556, no. 2. — P. 337—345. — ISSN 0022-3751. — doi:10.1113/jphysiol.2003.058842.
- ↑ Cai Xiang and Liang Conrad W.; Muralidharan, Sukuman; Kao, Joseph P.Y.; Tang, Cha-Min; Thompson, Scott M. Unique Roles of SK and Kv4.2 Potassium Channels in Dendritic Integration (англ.) // Neuron[англ.] : journal. — Cell Press, 2004. — Vol. 44, no. 2. — P. 351—364. — ISSN 08966273. — doi:10.1016/j.neuron.2004.09.026.
- ↑ Branco Tiago and Häusser Michael. The single dendritic branch as a fundamental functional unit in the nervous system (англ.) // Current Opinion in Neurobiology : journal. — Elsevier, 2010. — Vol. 20, no. 4. — P. 494—502. — ISSN 09594388. — doi:10.1016/j.conb.2010.07.009.
- ↑ 1 2 Lavzin Maria, Rapoport Sophia, Polsky Alon, Garion Liora, and Schiller Jackie. Nonlinear dendritic processing determines angular tuning of barrel cortex neurons in vivo (англ.) // Nature : journal. — 2012. — Vol. 490, no. 7420. — P. 397—401. — ISSN 0028-0836. — doi:10.1038/nature11451.
- ↑ Wei D.-S., Mei Y-A, Bagal A., Kao J.P.Y., Thompson S.M., and Tang C.-M. Compartmentalized and Binary Behavior of Terminal Dendrites in Hippocampal Pyramidal Neurons (англ.) // Science : journal. — 2001. — Vol. 293, no. 5538. — P. 2272—2275. — ISSN 00368075. — doi:10.1126/science.1061198.
- ↑ 1 2 3 Major Guy, Larkum Matthew E. and Schiller Jackie. Active Properties of Neocortical Pyramidal Neuron Dendrites (англ.) // Annual Review of Neuroscience : journal. — 2013. — Vol. 36, no. 1. — P. 1—24. — ISSN 0147-006X. — doi:10.1146/annurev-neuro-062111-150343.
- ↑ Polsky A., Mel B., and Schiller J. Encoding and Decoding Bursts by NMDA Spikes in Basal Dendrites of Layer 5 Pyramidal Neurons (англ.) // Journal of Neuroscience[англ.] : journal. — 2009. — Vol. 29, no. 38. — P. 11891—11903. — ISSN 0270-6474. — doi:10.1523/JNEUROSCI.5250-08.2009.
- ↑ 1 2 Major G., Polsky A., Denk W., Schiller J., and Tank D.W. Spatiotemporally Graded NMDA Spike/Plateau Potentials in Basal Dendrites of Neocortical Pyramidal Neurons (англ.) // Journal of Neurophysiology[англ.] : journal. — 2008. — Vol. 99, no. 5. — P. 2584—2601. — ISSN 0022-3077. — doi:10.1152/jn.00011.2008.
- ↑ 1 2 Polsky Alon, Mel Bartlett W and Schiller Jackie. Computational subunits in thin dendrites of pyramidal cells (англ.) // Nature Neuroscience : journal. — 2004. — Vol. 7, no. 6. — P. 621—627. — ISSN 1097-6256. — doi:10.1038/nn1253.
- ↑ 1 2 3 Ariav Gal, Polsky Alon , and Schiller Jackie. Submillisecond Precision of the Input–Output Transformation Function Mediated by Fast Sodium Dendritic Spikes in Basal Dendrites of CA1 Pyramidal Neurons (англ.) // The Journal of Neuroscience[англ.] : journal. — 2003. — 27 August (vol. 23). — P. 7750 —7758. Архивировано 30 ноября 2018 года.
- ↑ Schiller Jackie and Schiller Yitzhak. NMDA receptor-mediated dendritic spikes and coincident signal amplification (англ.) // Current Opinion in Neurobiology : journal. — Elsevier, 2001. — Vol. 11, no. 3. — P. 343—348. — ISSN 09594388. — doi:10.1016/S0959-4388(00)00217-8.
- ↑ 1 2 3 Gasparini S., Migliore M. and Magee J. On the Initiation and Propagation of Dendritic Spikes in CA1 Pyramidal Neurons (англ.) // Journal of Neuroscience[англ.] : journal. — 2004. — Vol. 24, no. 49. — P. 11046—11056. — ISSN 0270-6474. — doi:10.1523/JNEUROSCI.2520-04.2004.
- ↑ 1 2 Hausser M. Diversity and Dynamics of Dendritic Signaling (англ.) // Science. — 2000. — 27 October (vol. 290). — P. 739—744. — doi:10.1126/science.290.5492.739. Архивировано 28 сентября 2014 года.
- ↑ Colbert Costa M. and Pan Enhui. Ion channel properties underlying axonal action potential initiation in pyramidal neurons (англ.) // Nature Neuroscience : journal. — 2002. — Vol. 5, no. 6. — P. 533—538. — ISSN 10976256. — doi:10.1038/nn857.
- ↑ Magee Jeffrey C. and Cook Erik P. Somatic EPSP amplitude is independent of synapse location in hippocampal pyramidal neurons (англ.) // Nature Neuroscience : journal. — 2000. — Vol. 3, no. 9. — P. 895—903. — ISSN 10976256. — doi:10.1038/78800.
- ↑ Stuart Greg, Spruston Nelson, Sakmann Bert, and Häusser Michael. Action potential initiation and backpropagation in neurons of the mammalian CNS (англ.) // Trends in Neurosciences[англ.] : journal. — Cell Press, 1997. — Vol. 20, no. 3. — P. 125—131. — ISSN 01662236. — doi:10.1016/S0166-2236(96)10075-8.
- ↑ Larkum M. E. , Rioult M. G. , and Luscher H. R. Propagation of action potentials in the dendrites of neurons from rat spinal cord slice cultures (англ.) // Journal of neurophysiology[англ.] : journal. — 1996. — 1 January (vol. 75). — P. 154—170.
- ↑ Stuart Greg and Häusser Michael. Initiation and spread of sodium action potentials in cerebellar purkinje cells (англ.) // Neuron[англ.] : journal. — Cell Press, 1994. — Vol. 13, no. 3. — P. 703—712. — ISSN 08966273. — doi:10.1016/0896-6273(94)90037-X.
- ↑ Mainen, Z.F. and Sejnowski, T.J. Influence of dendritic structure on firing pattern in model neocortical neurons (англ.) // Nature : journal. — 1996. — 25 July (vol. 382). — P. 363—366. — doi:10.1038/382363a0. — PMID 8684467. Архивировано 17 октября 2013 года.
- ↑ 1 2 Spruston N., Schiller Y., Stuart G., and Sakmann B. Activity-dependent action potential invasion and calcium influx into hippocampal CA1 dendrites (англ.) // Science : journal. — 1995. — Vol. 268, no. 5208. — P. 297—300. — ISSN 0036-8075. — doi:10.1126/science.7716524.
- ↑ Goldstein Steven S. and Rall Wilfrid. Changes of Action Potential Shape and Velocity for Changing Core Conductor Geometry (англ.) // Biophysical Journal[англ.] : journal. — 1974. — Vol. 14, no. 10. — P. 731—757. — ISSN 00063495. — doi:10.1016/S0006-3495(74)85947-3.
- ↑ Spruston Nelson, Jaffe David B. and Johnston Daniel. Dendritic attenuation of synaptic potentials and currents: the role of passive membrane properties (англ.) // Trends in Neurosciences[англ.] : journal. — Cell Press, 1994. — Vol. 17, no. 4. — P. 161—166. — ISSN 01662236. — doi:10.1016/0166-2236(94)90094-9.
- ↑ Rapp M., Yarom Y. and Segev I. Modeling back propagating action potential in weakly excitable dendrites of neocortical pyramidal cells (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1996. — Vol. 93, no. 21. — P. 11985—11990. — ISSN 00278424. — doi:10.1073/pnas.93.21.11985.
- ↑ 1 2 Miles R., Toth K., Gulyas A., Hajos N., and Freund T. Differences between Somatic and Dendritic Inhibition in the Hippocampus (англ.) // Neuron[англ.] : journal. — Cell Press, 1996. — Vol. 16, no. 4. — P. 815—823. — ISSN 08966273. — doi:10.1016/S0896-6273(00)80101-4.
- ↑ Magee J. and Johnston D. Synaptic activation of voltage-gated channels in the dendrites of hippocampal pyramidal neurons (англ.) // Science : journal. — 1995. — Vol. 268, no. 5208. — P. 301—304. — ISSN 0036-8075. — doi:10.1126/science.7716525.
- ↑ 1 2 Magee J. C. A Synaptically Controlled, Associative Signal for Hebbian Plasticity in Hippocampal Neurons (англ.) // Science : journal. — 1997. — Vol. 275, no. 5297. — P. 209—213. — ISSN 00368075. — doi:10.1126/science.275.5297.209.
- ↑ Amitai Y., Friedman A., Connors B. W. and Gutnick M. J. Regenerative Activity in Apical Dendrites of Pyramidal Cells in Neocortex (англ.) // Cerebral Cortex : journal. — 1993. — Vol. 3, no. 1. — P. 26—38. — ISSN 1047-3211. — doi:10.1093/cercor/3.1.26.
- ↑ Kampa B. M. Calcium Spikes in Basal Dendrites of Layer 5 Pyramidal Neurons during Action Potential Bursts (англ.) // Journal of Neuroscience[англ.] : journal. — 2006. — Vol. 26, no. 28. — P. 7424—7432. — ISSN 0270-6474. — doi:10.1523/JNEUROSCI.3062-05.2006.
- ↑ Hausser M. Synaptic function: dendritic democracy (англ.) // Current Biology : journal. — Cell Press, 2001. — 9 January (vol. 11, no. 1). — P. R10—R12. — doi:10.1016/S0960-9822(00)00034-8. Архивировано 24 сентября 2015 года.
- ↑ Doiron Brent, Laing Carlo, Longtin André, and Leonard Maler; Leonard. {{{заглавие}}} (неопр.) // Journal of Computational Neuroscience. — 2002. — Т. 12, № 1. — С. 5—25. — ISSN 09295313. — doi:10.1023/A:1014921628797.
- ↑ Bliss T.V.P. and Collingridge G.L. A synaptic model of memory: long-term potentiation in the hippocampus (англ.) // Nature : journal. — 1993. — Vol. 361, no. 6407. — P. 31—39. — ISSN 0028-0836. — doi:10.1038/361031a0.
- ↑ Svoboda Karel, Denk Winfried, Kleinfeld David, and Tank David W. In vivo dendritic calcium dynamics in neocortical pyramidal neurons (итал.) // Nature : diario. — 1997. — V. 385, n. 6612. — P. 161—165. — ISSN 0028-0836. — doi:10.1038/385161a0.
- ↑ Yuste Rafael, Gutnick Michael J., Saar Drorit, Delaney Kerry R., Tank David W. Ca2+ accumulations in dendrites of neocortical pyramidal neurons: An apical band and evidence for two functional compartments (англ.) // Neuron[англ.] : journal. — Cell Press, 1994. — Vol. 13, no. 1. — P. 23—43. — ISSN 08966273. — doi:10.1016/0896-6273(94)90457-X.
- ↑ Tong G., Shepherd D., and Jahr C. Synaptic desensitization of NMDA receptors by calcineurin (англ.) // Science : journal. — 1995. — Vol. 267, no. 5203. — P. 1510—1512. — ISSN 0036-8075. — doi:10.1126/science.7878472.
- ↑ Bloodgood Brenda L., Sharma Nikhil, Browne Heidi Adlman, and Trepman Alissa Z.; Greenberg, Michael E. The activity-dependent transcription factor NPAS4 regulates domain-specific inhibition (англ.) // Nature : journal. — 2013. — Vol. 503, no. 7474. — P. 121—125. — ISSN 0028-0836. — doi:10.1038/nature12743.
- ↑ Maya-Vetencourt José Fernando. Activity-Dependent NPAS4 Expression and the Regulation of Gene Programs Underlying Plasticity in the Central Nervous System (англ.) // Neural Plasticity[англ.] : journal. — 2013. — Vol. 2013. — P. 1—12. — ISSN 2090-5904. — doi:10.1155/2013/683909.
- ↑ Stuart Greg J., Häusser Michael. Dendritic coincidence detection of EPSPs and action potentials (англ.) // Nature Neuroscience : journal. — 2001. — Vol. 4, no. 1. — P. 63—71. — ISSN 10976256. — doi:10.1038/82910.
- ↑ Sjöström Per Jesper, Häusser Michael. A Cooperative Switch Determines the Sign of Synaptic Plasticity in Distal Dendrites of Neocortical Pyramidal Neurons (англ.) // Neuron[англ.] : journal. — Cell Press, 2006. — Vol. 51, no. 2. — P. 227—238. — ISSN 08966273. — doi:10.1016/j.neuron.2006.06.017.
- ↑ London Michael and Häusser Michael. Dendritic computation (англ.) // Annual Review of Neuroscience. — 2005. — Vol. 28, no. 1. — P. 503—532. — ISSN 0147-006X. — doi:10.1146/annurev.neuro.28.061604.135703.
- ↑ Larkum M. E., Nevian T., Sandler M., Polsky A. and Schiller J. Synaptic Integration in Tuft Dendrites of Layer 5 Pyramidal Neurons: A New Unifying Principle (англ.) // Science : journal. — 2009. — Vol. 325, no. 5941. — P. 756—760. — ISSN 0036-8075. — doi:10.1126/science.1171958.
- ↑ 1 2 3 Larkum M.E., Senn В. and Lüscher H.-R. Top-down Dendritic Input Increases the Gain of Layer 5 Pyramidal Neurons (англ.) // Cerebral Cortex : journal. — 2004. — Vol. 14, no. 10. — P. 1059—1070. — ISSN 1460-2199. — doi:10.1093/cercor/bhh065.
- ↑ Giugliano M., Camera G., Fusi S., and Senn W. The response of cortical neurons to in vivo-like input current: theory and experiment: II. Time-varying and spatially distributed inputs (англ.) // Biological Cybernetics : journal. — 2008. — Vol. 99, no. 4—5. — P. 303—318. — ISSN 0340-1200. — doi:10.1007/s00422-008-0270-9.
- ↑ Lorente de No, R. and Condouris G.A. Decremental Conduction in Peripheral Nerve. Integration of Stimuli in the Neuron (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1959. — April (vol. 45). — P. 592—617.
- ↑ Gasparini S. and Magee. State-Dependent Dendritic Computation in Hippocampal CA1 Pyramidal Neurons (англ.) // Journal of Neuroscience[англ.] : journal. — 2006. — Vol. 26, no. 7. — P. 2088—2100. — ISSN 0270-6474. — doi:10.1523/JNEUROSCI.4428-05.2006.
- ↑ Jack James , Noble Denis , Tsien Richard W. Electric Current Flow in Excitable Cells (англ.). — Oxford University Press, 1975. — P. 518.
- ↑ Larriva-Sahd Jorge. Some contributions of Rafael Lorente de Nó to neuroscience: A reminiscence (англ.) // Brain Research Bulletin[англ.] : journal. — 2002. — Vol. 59, no. 1. — P. 1—11. — ISSN 03619230. — doi:10.1016/S0361-9230(02)00838-9.
Литература
Книги
- Dendrites (англ.) / Stuart G., Spruston N., Hausser M.. — Oxford University Press, 1999. — P. 139—160. — ISBN ISBN 0198566565..
- Hille, Bertil. Ionic Channels of Excitable Membranes (неопр.). — Sinauer Associates, Incorporated, 2001. — С. 814. — ISBN 9780878933211.
- Fundamental Neuroscience (неопр.) / Squire, Larry. — 3. — 2008. — С. 63. — ISBN 978-0-12-374019-9.
- Yuste, Rafael. Dendritic Spines (неопр.). — MIT Press, 2010. — С. 264. — ISBN 9780262013505.
- Koch, Christof. Biophysics of Computation: Information Processing in Single Neurons (англ.). — Oxford University Press, 2004. — P. 562. — ISBN 9780195181999.
- Neurosciences - From Molecule to Behavior: a university textbook (англ.) / Galizia, C. Giovanni and Lledo, Pierre-Marie. — Springer, 2013. — P. 736. — ISBN 978-3-642-10769-6.
Обзорные статьи
- Sjostrom P. J., Rancz E. A., Roth A., Hausser M. Dendritic Excitability and Synaptic Plasticity (англ.) // Physiological Reviews[англ.] : journal. — 2008. — Vol. 88, no. 2. — P. 769—840. — ISSN 0031-9333. — doi:10.1152/physrev.00016.2007.
- Hausser M. Diversity and Dynamics of Dendritic Signaling (англ.) // Science. — 2000. — 27 October (vol. 290). — P. 739—744. — doi:10.1126/science.290.5492.739.
- Major Guy, Larkum Matthew E. and Schiller Jackie. Active Properties of Neocortical Pyramidal Neuron Dendrites (англ.) // Annual Review of Neuroscience : journal. — 2013. — Vol. 36, no. 1. — P. 1—24. — ISSN 0147-006X. — doi:10.1146/annurev-neuro-062111-150343.
- London Michael and Häusser Michael. Dendritic computation (англ.) // Annual Review of Neuroscience. — 2005. — Vol. 28, no. 1. — P. 503—532. — ISSN 0147-006X. — doi:10.1146/annurev.neuro.28.061604.135703.
- Johnston D., Magee J. C., Colbert C. M., Christie B. R. Active Properties of Neuronal Dendrites (англ.) // Annual Review of Neuroscience. — 1996. — Vol. 19, no. 1. — P. 165—186. — ISSN 0147-006X. — doi:10.1146/annurev.ne.19.030196.001121.
- Mel Bartlett W. Information Processing in Dendritic Trees (англ.) // Neural Computation[англ.]. — 1994. — Vol. 6, no. 6. — P. 1031—1085. — ISSN 0899-7667. — doi:10.1162/neco.1994.6.6.1031.













