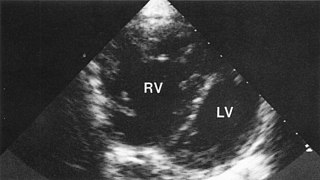
Дефект межжелудочковой перегородки
| Дефект межжелудочковой перегородки | |
|---|---|
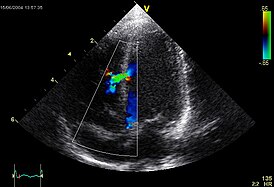 Эхокардиографическое изображение дефекта межелудочковой перегородки в мышечной части. | |
| МКБ-11 | LA88.4 |
| МКБ-10 | Q21.0 |
| МКБ-10-КМ | Q21.0 |
| МКБ-9 | 745.4 |
| МКБ-9-КМ | 745.4[1][2] |
| OMIM | 614429, 614431 и 614432 |
| DiseasesDB | 13808 |
| MedlinePlus | 001099 |
| eMedicine | med/3517 |
| MeSH | D006345 |

Дефе́кт межжелу́дочковой перегоро́дки (ДМЖП) — врожденный порок сердца, характеризующийся наличием дефекта между правым и левым желудочками сердца.
Эпидемиология
Дефект межжелудочковой перегородки (ДМЖП) — встречается наиболее часто, причём как в изолированном виде, так и в составе многих других пороков сердца. Среди ВПС частота данного порока варьирует от 27,7 до 42 %.[3] Одинаково часто встречается как у мальчиков, так и у девочек. Существуют данные об аутосомно-доминантном и рецессивном типах наследования. В 3,3 % случаев у прямых родственников больных с ДМЖП также обнаруживают этот порок.[4]
Классификация
В межжелудочковой перегородке выделяют 3 отдела: верхняя часть — мембранозная, прилегает к центральному фиброзному телу, средняя часть — мышечная, и нижняя — трабекулярная. Соответственно этим отделам называют и дефекты межжелудочковой перегородки, однако большинство из них имеют перимембранозную локализацию (до 80 %). На долю мышечных ДМЖП приходится 20 %[3][5].
По размерам дефекты подразделяют на большие, средние и малые. Для правильной оценки величины дефекта его размер надо сравнивать с диаметром аорты. Мелкие дефекты размером 1-2 мм, расположенные в мышечной части межжелудочковой перегородки, называются болезнью Толочинова-Роже. Вследствие хорошей аускультативной картины и отсутствия гемодинамических нарушений для их характеристики уместно выражение: «много шума из ничего». Отдельно выделяют множественные большие дефекты межжелудочковой перегородки, по типу «швейцарского сыра», имеющие неблагоприятное прогностическое значение[5].
Гемодинамика
Внутрисердечные гемодинамические нарушения при ДМЖП начинают формироваться спустя некоторое время после рождения, как правило, на 3—5 сутки жизни.[6]
В раннем неонатальном периоде шум в сердце может отсутствовать вследствие одинакового давления в правом и левом желудочках из-за так называемой неонатальной лёгочной гипертензии. Постепенное падение давления в системе легочной артерии и в правом желудочке создаёт разность (градиент) давлений между желудочками, вследствие чего появляется сброс крови слева направо (из области высокого давления в область низкого давления). [7][8] Дополнительный объём крови, поступающий в правый желудочек и лёгочную артерию, приводит к переполнению сосудов малого круга кровообращения, где развивается лёгочная гипертензия.
Выделяют три стадии легочной гипертензии по В. И. Бураковскому.
- Застой крови (гиперволемическая стадия лёгочной гипертензии) может приводить к отёку легких, частому присоединению инфекции, развитию пневмоний, манифестирующих в ранние сроки жизни, имеющих тяжёлое течение и плохо поддающихся лечению. Если с гиперволемией не удается справиться консервативными методами, проводят паллиативную операцию — сужение лёгочной артерии по Мюллеру. Суть операции заключается в создании временного искусственного стеноза лёгочной артерии, который препятствует попаданию в МКК избыточного количества крови. Однако повышенная нагрузка, падающая при этом на правый желудочек, диктует в дальнейшем (спустя 3—6 месяцев) необходимость проведения радикальной операции.[9]
- При естественном течении порока со временем в сосудах малого круга кровообращения срабатывает рефлекс Китаева (спазмирование в ответ на перерастяжение), что приводит к развитию переходной стадии лёгочной гипертензии. В этот период ребёнок перестает болеть, становится более активным, начинает прибавлять в весе. Стабильное состояние пациента в эту фазу является лучшим периодом для проведения радикальной операции.[9] Давление в лёгочной артерии (и соответственно в правом желудочке) в эту фазу колеблется в пределах от 30 до 70 мм рт. ст. Аускультативная картина характеризуется уменьшением интенсивности шума при появлении акцента II тона над лёгочной артерией.[5]
- В дальнейшем, если хирургическая коррекция ВПС не проводится, начинают формироваться процессы склерозирования сосудов легких (высокая легочная гипертензия — синдром Эйзенменгера). Этот патологический процесс не имеет обратного развития и приводит к значительному повышению давления в лёгочной артерии (иногда до 100—120 мм рт. ст.).[5]
Аускультативно можно выслушать резко выраженный акцент II тона над лёгочной артерией («металлический» оттенок).[10] Систолический шум становится слабо-интенсивным, а в некоторых случаях может совсем отсутствовать. На этом фоне можно зафиксировать появление нового диастолического шума, обусловленного недостаточностью клапанов лёгочной артерии (шум Грехема-Стилла).[10] В клинической картине заболевания отмечается множество патологических признаков: сердечный «горб», расширение границ относительной сердечной тупости, больше вправо. Над лёгкими выслушиваются участки ослабленного и жёсткого дыхания, могут встречаться свистящие хрипы. Самым характерным признаком синдрома Эйзенменгера является постепенное нарастание цианоза, — сначала периферического, а в дальнейшем и диффузного. Это происходит вследствие перекрестного сброса крови в области дефекта межжелудочковой перегородки, который при превышении давления в правом желудочке становится право-левым, то есть меняет своё направление. Наличие у пациента третьей стадии лёгочной гипертензии может стать основным мотивом отказа кардиохирургов от проведения операции.[6]
Клиническая картина
Клиническая картина при ДМЖП заключается в симптомокомплексе сердечной недостаточности, развивающейся, как правило, на 1-3 месяцах жизни (в зависимости от размеров дефекта).[8] Кроме признаков сердечной недостаточности ДМЖП может манифестировать ранними и тяжелыми пневмониями. При осмотре ребёнка можно выявить тахикардию и одышку, расширение границ относительной сердечной тупости, смещение верхушечного толчка вниз и влево. В ряде случаев определяется симптом «кошачьего мурлыканья». Систолический шум, как правило, интенсивный, выслушивается над всей областью сердца, хорошо проводится на правую сторону грудной клетки и на спину с максимальной интенсивностью в IV межреберье слева от грудины. При пальпации живота определяется гепатомегалия и спленомегалия. Изменения периферической пульсации не характерны. У детей с ДМЖП как правило быстро развивается гипертрофия.
Диагностика
Диагностика любого порока сердца складывается из рентгенологического исследования органов грудной полости, электрокардиографии и двухмерной доплерэхокардиографии.
При рентгенологическом исследовании органов грудной клетки описывают форму сердца и состояние лёгочного рисунка, определяют размер кардио-торакального индекса (КТИ). Все эти показатели имеют свои особенности при разных степенях лёгочной гипертензии. В первой, гиперволемической стадии, выявляется сглаженность талии и погруженность верхушки сердца в диафрагму, увеличение КТИ. Со стороны легочного рисунка отмечается его усиление, нечёткость, размытость. Крайней степенью гиперволемии в лёгких является отёк лёгких. В переходной стадии лёгочной гипертензии отмечается нормализация лёгочного рисунка, некоторая стабилизация размеров КТИ. Для склеротической стадии лёгочной гипертензии характерно значительное увеличение размеров сердца, причем в основном за счёт правых отделов, увеличение правого предсердия (формирование прямого атрио-вазального угла), выбухание дуги лёгочной артерии (индекс Мура более 50 %), приподнятость верхушки сердца, которая образует с диафрагмой острый угол. Со стороны лёгочного рисунка часто описывается симптом «обрубленного дерева»: яркие, чёткие, увеличенные корни, на фоне которых лёгочный рисунок прослеживается только до определённого уровня. На периферии имеет место признаки эмфиземы. Грудная клетка имеет вздутую форму, ход ребер горизонтальный, диафрагма уплощена, стоит низко.[9]
ЭКГ имеет свои закономерности, тесно связанные с фазой течения ВПС и степенью лёгочной гипертензии. Сначала выявляются признаки перегрузки левого желудочка — повышение его активности, затем развитие его гипертрофии. С течением времени присоединяются признаки перегрузки и гипертрофии правых отделов сердца — как предсердия, так и желудочка, — это свидетельствует о высокой лёгочной гипертензии. Электрическая ось сердца всегда отклонена вправо. Могут встречаться нарушения проводимости — от признаков неполной блокады правой ножки пучка Гиса до полной атрио-вентрикулярной блокады.[10]
При доплер-ЭхоКГ уточняется место расположения дефекта, его размер, определяется давление в правом желудочке и лёгочной артерии. В первой стадии лёгочной гипертензии давление в ПЖ не превышает 30 мм.рт.ст., во второй стадии — от 30 до 70 мм.рт.ст., в третьей — более 70 мм.рт.ст.[6]
Лечение
Лечение данного порока подразумевает консервативную терапию сердечной недостаточности и хирургическую коррекцию порока сердца. Консервативное лечение складывается из препаратов инотропной поддержки (симпатомиметики, сердечные гликозиды), мочегонных препаратов, кардиотрофиков.[8] В случаях высокой лёгочной гипертензии назначаются ингибиторы ангиотензинпревращающего фермента — капотен или каптоприл.
Оперативные вмешательства подразделяются на паллиативные операции (в случае ДМЖП — операция суживания лёгочной артерии по Мюллеру) и радикальную коррекцию порока — пластика дефекта межжелудочковой перегородки заплатой из листков перикарда в условиях искусственного кровообращения, кардиоплегии и гипотермии.[5]
Примечания
- ↑ Disease Ontology (англ.) — 2016.
- ↑ Monarch Disease Ontology release 2018-06-29 — 2018-06-29 — 2018.
- ↑ 1 2 Шарыкин. Врожденные пороки сердца. — Теремок, 2005. — 384 с.
- ↑ http://www.mma.ru/article/id34653 Архивная копия от 2 мая 2009 на Wayback Machine Дефект межжелудочковой перегородкм. Медицинская энциклопедия ММА
- ↑ 1 2 3 4 5 Прахов А.В. Неонатальная кардиология. — НГМА, 2008. — 388 с.
- ↑ 1 2 3 Банкл Г. Врожденные пороки сердца и крупных сосудов. — 1980. — 312 с.
- ↑ Вишневский А.А., Галанкин Н.К. Врожденные пороки сердца и крупных сосудов. — 1962. — 210 с.
- ↑ 1 2 3 Белозеров Ю.М. Детская кардиология. — МЕДпресс-информ, 2004. — 600 с.
- ↑ 1 2 3 Белоконь Н.А., Подзолков В.П. Врожденные пороки сердца. — 1991. — 352 с.
- ↑ 1 2 3 Василенко В.Х.,Фельдман С.Б., Могилевский Э.Б. Пороки сердца. — 1983. — 366 с.
Литература
- Банкл Г. Врожденные пороки сердца и крупных сосудов. — 1980. — 312 с.
- Белозеров Ю.М. Детская кардиология. — МЕДпресс-информ, 2004. — 600 с.
- Белоконь Н.А., Подзолков В.П. Врожденные пороки сердца. — 1991. — 352 с.
- Василенко В.Х.,Фельдман С.Б., Могилевский Э.Б. Пороки сердца. — 1983. — 366 с.
- Вишневский А.А., Галанкин Н.К. Врожденные пороки сердца и крупных сосудов. — 1962. — 210 с.
- Имре Литтманн, Рене Фоно. Врожденные пороки сердца и крупных сосудов. — 1954. — 232 с.
- Прахов А.В. Неонатальная кардиология. — НГМА, 2008. — 388 с.
- Шарыкин. Врожденные пороки сердца. — Теремок, 2005. — 384 с.