Димер
Диме́р (от др.-греч. δι- «два» + μέρος «часть») — сложная молекула, составленная из двух более простых молекул, называемых мономерами данной молекулы[1][2].
Димеры могут состоять как из одинаковых мономеров (гомодимеры), так и из разных мономеров (гетеродимеры). Мономеры могут быть как органическими, так и неорганическими.
У благородных газов, которые в силу своей инертности не образуют молекул, димерами называют двухатомные молекулы, появление которых возможно при возбуждённом состоянии атомов (см. эксимер).
Когда два противоположно заряженных иона объединяются в димер, они называются парой Бьеррума в честь Нильса Бьеррума[3].
Нековалентные димеры

Карбоновые кислоты образуют димеры за счет водородных связей кислого водорода и карбонильного кислорода в безводном состоянии. Например, уксусная кислота образует димер в газовой фазе, где мономерные звенья удерживаются вместе водородными связями. В особых условиях большинство ОН-содержащих молекул образуют димеры, например димер воды.
Боран («BH3») встречается в виде димера диборана (B2H6) из-за высокой льюисовской кислотности борного центра.
Эксимеры и эксиплексы — это возбужденные структуры с коротким временем жизни. Например, благородные газы в силу своей инертности не образуют молекул, но образуют эксимеры Ar2*, Kr2* и Xe2* под высоким давлением и электростимуляцией.
Специфическая каталитическая активность

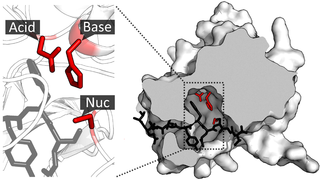
Существует как минимум два типа димеров, демонстрирующих специфическую каталитическую активность, не свойственную соответствующим мономерам[4]: в одном случае, на мономере попросту отсутствует активный сайт — каталитический центр, такой центр создается лишь после димеризации, при сближении или соединении активных остатков с соответствующих мономеров. Примером может служить сближение остатков аспарагиновой кислоты при образовании аспарагиновой протеазы, фермента, играющего важную роль в цикле жизнедеятельности вируса иммунодефицита.[4] К другому типу относятся димеры, каждый мономер которых оснащен каталитическим центром, но которые активируются лишь после димеризации. Примером может служить протеаза вируса герпеса, где оба каталитических центра даже не сближаются в процессе димеризации.[4] Современные научные представления связывают каталитическую активность последних с вибрационными модами, которые не поддерживаются в мономерах по-отдельности, и которые значительно уменьшают энергию переходного состояния, и, как следствие, общий барьер реакции.[5]
Известна, и продолжает изучаться каталитическая активность гетеродимеров, в особенности биметаллических систем (Au-Ag, Pt-Rh и др.)[6][7]
Релаксационные процессы
Под релаксацией понимается задержка в установлении равновесных параметров системы после внешнего воздействия. Одним из таких параметров является давление, связанное с количеством частиц в системе. Процесс распада или возникновения димеров меняет это число вдвое и, иногда, может быть легко наблюдаем: например оксид азота (мономер) бесцветен, а газ, состоящий из соответствующих димеров имеет коричневую окраску. Равновесие выражается реакцией распада/воссоединения димера N2O4 ⇌ 2 NO2, причем среднее время жизни димера здесь около трети микросекунды. Этим обусловлена задержка в установлении химического равновесия (соотношения между количеством димеров и мономеров в газе) при уменьшении внешнего давления, что вызывает, например, поглощение и дисперсию звуковых волн в подобных средах.[2][8]
Применение
Примерами использования неорганических димеров могут служить эксимерный лазер и эксилампа.
Литература
Димер в Национальной энциклопедии (швед.).
См. также
Примечания
- ↑ Димер Архивная копия от 24 апреля 2016 на Wayback Machine в Национальной энциклопедии (швед.)
- ↑ 1 2 Димер Архивная копия от 16 июля 2019 на Wayback Machine в Энциклопедии Британника (англ.).
- ↑ Adar, Ram M.; Markovich, Tomer; Andelman, David (2017-05-17). "Bjerrum pairs in ionic solutions: A Poisson-Boltzmann approach". The Journal of Chemical Physics. 146 (19): 194904. arXiv:1702.04853. Bibcode:2017JChPh.146s4904A. doi:10.1063/1.4982885. ISSN 0021-9606. PMID 28527430.
- ↑ 1 2 3 doi:10.1038/nsb0901-810
- ↑ doi:10.1038/nchembio.202
- ↑ The morphology and catalytic activity of bimetallic nanoclusters supported on TiO2(110) by Ratliff, Jay, Ph.D., UNIVERSITY OF SOUTH CAROLINA, 2009
- ↑ doi:10.1039/C4NJ01328J
- ↑ Релаксационные процессы Архивная копия от 12 октября 2018 на Wayback Machine в Энциклопедии Британника (англ.).