
Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс и другие комплексы.
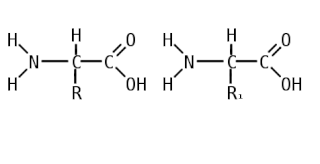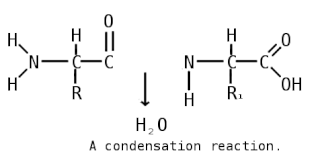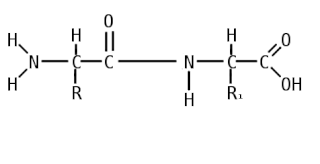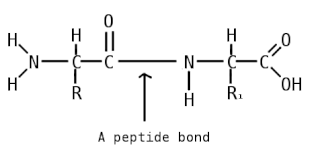
Пепти́ды — семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединённых в цепь пептидными (амидными) связями −C(O)NH−. Обычно подразумеваются пептиды, состоящие из  -аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.
-аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.

В биологии активный центр — это область фермента, где молекулы субстрата связываются и подвергаются химической реакции. Активный центр состоит из аминокислотных остатков, которые образуют временные связи с субстратом, и остатков, которые катализируют реакцию этого субстрата. Хотя активный центр занимает только ~ 10-20 % от объёма фермента он является наиболее важной частью, поскольку он непосредственно катализирует химическую реакцию. Обычно активный центр состоит из трех-четырех аминокислот, в то время как другие аминокислоты в белке необходимы для поддержания его третичной структуры.

Посттрансляционная модификация — это ковалентная химическая модификация белка после его синтеза на рибосоме. Для многих белков посттрансляционная модификация оказывается завершающим этапом биосинтеза, который является частью процесса экспрессии генов. Наряду с альтернативным сплайсингом посттрансляционные модификации увеличивают разнообразие белков в клетке.

В биохимии и молекулярной биологии фо́лдингом белка называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру.
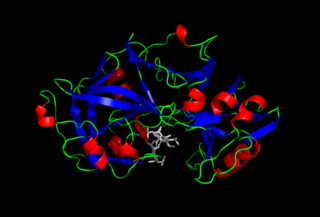
Пепси́н — протеолитический фермент класса гидролаз образуется из своего предшественника пепсиногена, вырабатываемого главными клетками слизистой оболочки желудка, и осуществляет расщепление белков пищи до пептидов. Присутствует в желудочном соке человека и других млекопитающих, птиц, пресмыкающихся и большинства рыб.
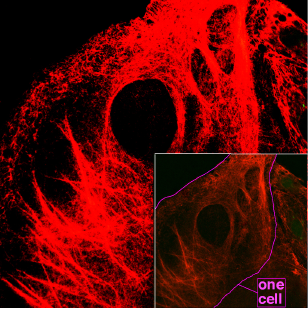
Кератины — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога носорогов, перья и рамфотека клюва птиц и др.

Интерлейкин 8, или хемокин CXCL8, — один из основных провоспалительных хемокинов, образуемый макрофагами, эпителиальными и эндотелиальными клетками. Играет также важную роль в системе врождённого иммунитета. Относится к хемокинам подсемейства CXC. На клетках-мишенях связывается с двумя рецепторами CXCR1 и CXCR2, первый из которых характеризуется более высокой эффективностью.

Цисти́н — алифатическая серосодержащая аминокислота, бесцветные кристаллы, плохо растворимы в холодной воде (1:9000), растворимы в минеральных кислотах и органических растворителях.
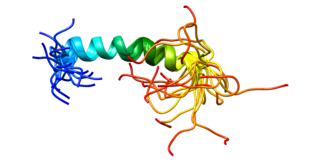
PECAM-1, или CD31, — гликопротеин, мембранный белок из суперсемейства иммуноглобулинов, относится к классу молекул клеточной адгезии. Один из основных белков межклеточных контактов эндотелиальных клеток: одна клетка может содержать до 1 млн копий белка. Часто используется как маркёр эндотелия при иммуногистологическом анализе ткани. Обнаружен также в ме́ньших количествах на циркулирующих тромбоцитах, моноцитах, нейтрофилах и на некоторых типах Т-клеток. Он также относится к подгруппе белков с ингибиторным ITIM участком. Всего известно 30 ITIM-содержащих белков.
Суперсемейство трансформирующего ростового фактора Beta (ТРФ-B) — большое семейство структурно связанных регуляторных белков, которое было названо по его первому члену, ТРФ-B1, впервые описанном в 1983 году.
Кластерин — гетеродимерный белок молекулярной массой 75-80 кДа, полипептидные цепи которого связаны дисульфидными мостиками. Его функции связаны с расщеплением клеточного «мусора» и регуляцией апоптоза.
CD9 — мембранный белок, гликопротеин из надсемейства тетраспанинов. Белок был открыт в 1981 году и стал первым представителем семейства белков тетраспанинов, включающим на настоящий момент 34 белка млекопитающих, из которых 33 найдены у человека. CD9 играет роль в клеточной миграции и адгезии.

Интегрин альфа-6 — мембранный белок, гликопротеин из надсемейства интегринов, продукт гена ITGA6, альфа-субъединица интегринов α6β1 и α6β4, рецепторов ламинина. Играет важную роль в связывании клеток эпителия.
Трансформирующий фактор роста бета — белок, который контролирует пролиферацию, клеточную дифференцировку и другие функции в большинстве клеток. Участвует в иммунном ответе, раке, сердечно-сосудистых заболеваниях, сахарном диабете, синдроме Марфана, синдроме Лойеса-Дитса, болезни Паркинсона и синдроме приобретённого иммунодефицита (СПИД).

Те́терин, или костномозговой стромальный клеточный антиген 2, — мембранный белок, фактор рестрикции (ингибитор) вирусных инфекций, включая ВИЧ. Продукт гена человека BST2.

Фактор ускорения распада комплемента, или CD55 — мембранный белок, ингибитор системы комплемента. Продукт гена человека CD55.

Тиоредоксины — семейство маленьких белков, представленный во всех организмах от архей до человека. Они участвуют во многих важных биологических процессах, включая определение окислительно-восстановительного потенциала клетки и передачу сигнала. У человека тиоредоксин кодируется геном TXN. Мутации, приводящие к потере функциональности даже одного аллеля этого гена, приводят к смерти на стадии четырёхклеточного эмбриона. Тиоредоксин играет значительную роль в организме человека, хотя и не до конца ясно какую именно. Всё чаще и чаще его возможные функции связывают с действием лекарств и противодействием активным формам кислорода. У растений тиоредоксины регулируют целый спектр жизненно важных функций, начиная от фотосинтеза и роста и заканчивая цветением, развитием и прорастанием семян. А совсем недавно выяснилось, что они также участвует в межклеточном взаимодействии и обмене информацией между растительными клетками.
Непротеиногенные аминокислоты — аминокислоты, которые не участвуют в биосинтезе белка. Непротеиногенные аминокислоты часто не входят в состав непатогенных и «нормальных» белков человека, не следует их путать с нестандартными аминокислотами, которые образуются непосредственно при синтезе белка или в результате различных ковалентных модификаций молекулярных структур протеиногенных (кодируемых) аминокислот в составе белков, например, гидроксипролина, десмозина или аллизина. Однако они могут входить в состав некоторых небольших молекул или пептидов, синтез которых является нерибосомальным. Химически синтезированные аминокислоты можно назвать неприродными аминокислотами. Многие из них являются токсинами и ингибиторами ферментов разнообразных метаболических реакций. Известно свыше 400 природных аминокислот и, возможно, больше тысячи их комбинаций. Неприродные аминокислоты могут быть синтетически получены из их нативных аналогов с помощью модификаций, таких как алкилирование аминогруппы, замещение боковой цепи, циклизация за счёт удлинения структурных связей и изостерических замен в аминокислотном остове.
CD70, также лиганд CD27LG, или TNFSF7 — цитокин семейства факторов некроза опухоли, в основном, локализующийся на активированных T- и B-лимфоцитах. Лиганд рецептора CD27, участвующего в долговременном выживании активированных T-лимфоцитов. Продукт гена человека CD70.















