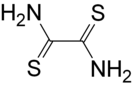Со́ли — сложные вещества, состоящие из катионов металлов и анионов кислотных остатков. ИЮПАК определяет соли как химические соединения, состоящие из катионов и анионов. Есть ещё одно определение: солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды.

Ни́кель — химический элемент 10-й группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 28.
Неоргани́ческая хи́мия — раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Эта область охватывает все химические соединения, за исключением органических веществ. Различия между органическими и неорганическими соединениями, содержащими углерод, являются по некоторым представлениям произвольными. Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества. Обеспечивает создание материалов новейшей техники. Число известных на 2013 г. неорганических веществ приближается к 500 тысячам.

Аналити́ческая хи́мия — наука, развивающая теоретические основы химического анализа веществ и материалов и разрабатывающая методы идентификации, обнаружения, разделения и определения химических элементов и их соединений, а также методы установления химического состава веществ. Проведение химического анализа в настоящее время заключается в получении информации о составе и природе вещества.
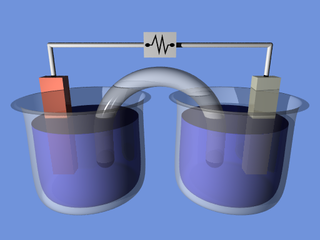
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Кисло́ты — химические соединения, способные отдавать катион водорода, либо соединения, способные принимать электронную пару с образованием ковалентной связи.

Водоро́дный показа́тель (pH [пэ-аш] ← лат. pondus Hydrogenii «вес водорода») — мера кислотности водных растворов. Является способом выражения активности катионов водорода в растворах. Противоположна по знаку и равна по модулю десятичному логарифму активности (а) катионов водорода (Н+), выраженной в молях на литр, которую в сильно разбавленных растворах можно считать равной их равновесной молярной концентрации ([H+]):
 .
.
Анио́н — отрицательно заряженный ион.
Неорганические сульфиды (от лат. sulphur — сера) — класс химических соединений, представляющих собой соединения металлов (а также ряда неметаллов — В, Si, Р, As) с серой (S), где она имеет степень окисления −2. Могут рассматриваться как соли сероводородной кислоты H2S. Свойства сульфидов сильно зависят от металлов, входящих в их состав.
Хроматы — соли хромовой кислоты H2CrO4. Устойчивы в нейтральной и щелочной среде, в кислой среде обратимо переходят в дихроматы — соли дихромовой кислоты H2Cr2O7.

Циани́ды — соли цианистоводородной (синильной) кислоты. В номенклатуре IUPAC к цианидам относят также C-производные синильной кислоты — нитрилы.
Аммиака́ты (амми́ны, аммѝноко́мплексы) — продукты взаимодействия солей с аммиаком, комплексные соединения, содержащие в качестве лигандов молекулы аммиака. Лиганды NH3 связаны в аммиакатах с центральным атомом металла через азот.

Иодиды — бинарные соединения иода с менее электроотрицательными элементами. Иодиды металлов могут рассматриваться как соли иодоводородной кислоты HI.

Ко́мплексные соедине́ния или координацио́нные соедине́ния — это соединения, которые образуются в результате присоединения к данному иону, называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений была предложена в 1893 г. А. Вернером.

Дина́триевая соль этилендиаминтетрау́ксусной кислоты́ — органическое соединение, натриевая соль этилендиаминтетрауксусной кислоты, представляет собой белый кристаллический порошок или кристаллы белого цвета. Хорошо растворяется в воде и щелочах, очень слабо растворяется в спирте; водный 1 % раствор имеет рН 4,5; препарат с массовой долей 5 % — рН 4—5,5.

Нитрозосоединения — органические, содержащие одну или несколько нитрозогрупп —N=O, связанных с атомами углерода (C-нитрозосоединения), азота (N-нитрозосоединения — нитрозамины, R2N-N=O) или кислорода (O-нитрозосоединения — органические нитриты, сложные эфиры азотистой кислоты), серы (нитрозотиолы, RS-N=O). Под нитрозосоединениями обычно подразумевают C-нитрозосоединения. Можно рассматривать эти соединения, как углеводородные производные нитрозила. Известны и неорганические нитрозильные соединения, как с металлами (M-N=O) так и с неметаллами (например, Cl-N=O, NO-ClO4).
Перехо́дные мета́ллы (перехо́дные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях. В общем виде электронное строение переходных элементов можно представить следующим образом:  . На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на
. На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на  -орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
-орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.

Хлори́ды — химические соединения хлора с менее электроотрицательными элементами, в которых он проявляет степень окисления –1.
Сульфат ванадия(II) — неорганическое соединение, соль металла ванадия и серной кислоты с формулой VSO4, образует кристаллогидраты — красно-фиолетовые кристаллы, растворимые в воде.

Хлорид родия(III) (трихлорид родия) — неорганическое соединение, соль родия и соляной кислоты с формулой RhCl3, один из трёх известных хлоридов родия, соответствующий трёхвалентному металлу. Красно-коричневый порошок, нерастворим в воде. Образует кристаллогидрат состава RhCl3•3H2O, хорошо растворимый в воде. Применяется для родирования — нанесения родиевых покрытий на металлы и как катализатор в органическом синтезе. Также находит применение в фотографии и производстве фотобумаг.