Дифенилкетен
| Дифенилкетен | |
|---|---|
 | |
| Общие | |
| Хим. формула | C14H10O |
| Классификация | |
| Рег. номер CAS | 525-06-4 |
| PubChem | 123069 |
| SMILES | |
| InChI | |
| ChemSpider | 109691 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дифенилкете́н — химическое вещество принадлежащее к классу кетенов. Дифенилкетен, как и большинство дизамещенных кетенов, представляет собой масло красно-оранжевого цвета при комнатной температуре и давлении . Благодаря последовательным двойным связям в структуре кетена R1R2C=C=O, дифенилкетен является гетерокумуленом. Наиболее важной реакцией дифенилкетена является реакция циклоприсоединение [2 + 2] по кратным связям CC, CN, CO и CS.[1]
История
Дифенилкетен был впервые получен и выделен Германом Штаудингером в 1905 году[2] с химической формулой R1R2C=C=O.
Получение
Первый синтез Х. Штаудингера был основан на реакции 2-хлордифенилацетилхлориде (полученным из бензиловой кислоты и тионилхлорида[3]) с цинком, в результате которой, два атома хлора отщепляются цинком в реакции дегалогенирования:[2]

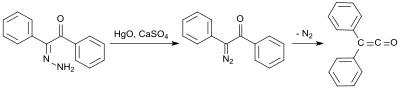
Раннее, в реакциях получения использовали бензилмоногидразон (полученный из дифенилэтандиона и гидразингидрата[4]), который окисляется оксидом ртути (II) и сульфатом кальция с образованием монодиазокетона, а затем превращается в дифенилкетен при 100 °C с выделением азота с выходом 58 %:[5]
Ещё одна реакция получения дифенилкетена была впервые получена Эдуардом Ведекиндом, который в 1901 году получил дифенилкетен дегидрогалогенированием дифенилацетилхлорида триэтиламином, однако без выделения как отдельного вещества и его описания.[6] Этот способ получения был также описан в 1911 г. Х. Штаудингером.[7]
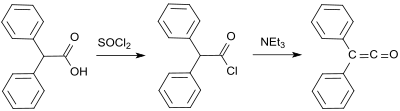
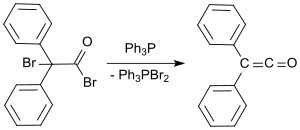
Стандартный лабораторный способ получения основан на методе Штаудингера и позволяет получить дифенилкетен в виде оранжевого масла с выходом от 53 до 57 %.[8] В более поздних лабораторных способах получения, дифенилкетен получают реакцией 2-бром-2,2-дифенилацетилбромид с трифенилфосфином с выходом до 81 %.[9]
Сообщалось о реакции получения дифенилкетена из дифенилуксусной кислоты и реактива Хендриксона (трифторметансульфонат ангидрида трифенилфосфония)[10] с отщеплением воды с выходом 72 %.[11]

Свойства
Дифенилкетен при комнатной температуре представляет собой масло оранжевого или красного цвета (с цветом концентрированного раствора дихромата калия[2]), которое смешивается с неполярными органическими растворителями (такими как диэтиловый эфир, ацетон, бензол, тетрагидрофуран, хлороформ)[12] и затвердевает на холоде, образуя желтые кристаллы.[2] Состав легко окисляется воздухом, но может храниться в плотно закрытых емкостях при 0 °С в течение нескольких недель без разложения или в атмосфере азота с добавлением небольшого количества гидрохинона как ингибитора полимеризации.
Дифенилкетен может подвергаться атаке множества нуклеофилов, включая спирты, амины и еноляты, но с достаточно медленной скоростью. Скорость может быть увеличена при использовании катализаторов. В настоящее время механизм атаки неизвестен, но ведутся работы по определению точного механизма.
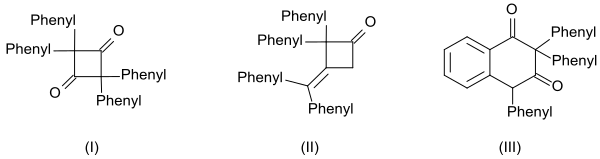
Высокая реакционная способность дифенилкетена также проявляется в образовании трех димеров:[13]
- циклический дикетон 2,2,4,4-тетрафенилциклобутан-1,3-дион (I) путем нагревания с хинолином
- β-лактон 4- (дифенилметилен)-3,3-дифенилоксетан-2-он (II) путем нагревания с метоксидом натрия
- производное тетралина 2,2,4-трифенилнафталин-1,3- (2H,4H)-дион (III) путем нагревания с бензоилхлоридом
и олигомеров, полученных из них.
Применение
Кетены (общей формулы R1R2C=C=O) имеют множество схожих свойств с изоцианатами (с общей формулой RN=C=O), в частности, схожи по-своему строению и реакционной способности.
Дифенилкетен реагирует с водой в реакции присоединения с образованием дифенилуксусной кислоты, с этанолом до дифенилуксусного этилового эфира или с аммиаком до соответствующего амида.[2] Карбоновые кислоты позволяют получить смешанные ангидриды дифенилуксусной кислоты, которые можно использовать для активации защищенных аминокислот для пептидной связи.
Так, защищенный дипептид Z-Leu-Phe-OEt (этиловый эфир N-бензилоксикарбонил-L-лейцил-L-фенилаланина) получают с выходом 59 % путем активации Z-лейцина дифенилкетеном и последующей реакции с этиловым эфиром фенилаланина.[14]
Дифенилкетен склонен к автоокислению, при этом соответствующий полиэфир образуется при температуре выше 60 ° С через промежуточное вещество — дифенилацетолактон:[15]

Аллены можно получить из дифенилкетена реакцией Виттига:[16]

С трифенилфосфиндифенилметиленом и дифенилкетеном при 140 °C и под давлением образуются тетрафенилаллены с выходом 70 %.[17]
Наиболее интересными реакциями дифенилкетена являются [2 + 2] циклоприсоединения, например реакция с циклопентадиеном с образованием аддукта Дильса-Альдера:[18]

Имины, такие как бензаланилин, образуют β-лактамы с дифенилкетеном:
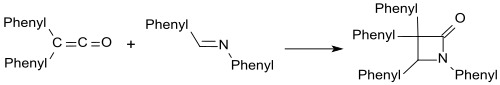
Аналогично с карбонильными соединениями образуются β-лактоны.[19]
[2 + 2] циклоприсоединение дифенилкетена к фенилацетилену сначала приводит к циклобутенону, который ароматизируется под действием нагревания до фенилвинилкетена и циклизуется в результате [4 + 2] циклоприсоединения к 3,4-дифенил-1-нафтолу с выходом 81 %[20].

На основе этой, так называемой реакции Смита-Хёна, был разработан общий метод синтеза замещенных фенолов и хинонов.[21]
Примечания
- ↑ Ulrich, H. (1967), Cycloaddition Reactions of Heterocumulenes, New York: Academic Press, p. 374
- ↑ 1 2 3 4 5 Staudinger, H. (1905). "Ketene, eine neue Körperklasse" (нем.). 38 (2): 1735—1739. doi:10.1002/cber.19050380283. Архивировано 18 апреля 2021. Дата обращения: 13 сентября 2021.
{{cite journal}}: Cite journal требует|journal=() - ↑ King, F.E. (1947), "Synthetic mydriatics. Diphenylchloroacetyl chloride as a reagent for the preparation of benzylic esters of tertiary amino-alcohols", J. Chem. Soc., pp. 164—168, doi:10.1039/JR9470000164
- ↑ Curtius, T.; Thun, K. (1891), "Einwirkung von Hydrazinhydrat auf Monoketone und Orthodiketone", J. Prakt. Chem., vol. 44, no. 2, pp. 161—186, doi:10.1002/prac.18910440121, Архивировано 13 сентября 2021, Дата обращения: 13 сентября 2021 Источник. Дата обращения: 13 сентября 2021. Архивировано 13 сентября 2021 года.
- ↑ Smith, L.I.; Hoehn, H.H., "Diphenylketene [Ketene, diphenyl-]", Org. Synth.[англ.], 20: 47, doi:10.15227/orgsyn.020.0047
- ↑ Wedekind, E. (1901), "Ueber die Gewinnung von Säureanhydriden mit Hülfe von tertiären Aminen", Ber. Dtsch. Chem. Ges., vol. 34, no. 2, pp. 2070—2077, doi:10.1002/cber.190103402122, Архивировано 13 сентября 2021, Дата обращения: 13 сентября 2021 Источник. Дата обращения: 13 сентября 2021. Архивировано 13 сентября 2021 года.
- ↑ Staudinger, H. (1911), "Über Ketene.XIX. Über Bildung und Darstellung des Diphenylketens", Ber. Dtsch. Chem. Ges., vol. 44, no. 2, pp. 1619—1623, doi:10.1002/cber.19110440258, Архивировано 13 сентября 2021, Дата обращения: 13 сентября 2021 Источник. Дата обращения: 13 сентября 2021. Архивировано 13 сентября 2021 года.
- ↑ Taylor, E.C.; McKillop, A, "Diphenylketene [Ethenone, diphenyl-]", Org. Synth.[англ.], 52: 36, doi:10.15227/orgsyn.052.0036
- ↑ Darling, S.D.; Kidwell, R.L. (1968), "Diphenylketene. Triphenylphosphine dehalogenation of .alpha.-bromodiphenylacetyl bromide", J. Org. Chem., vol. 33, no. 10, pp. 3974—3975, doi:10.1021/jo01274a074
- ↑ McCauley, J.I. (2012), "Hendrickson reagent (triphenylphosphonium anhydride trifluormethane sulfonate", Synlett, vol. 23, no. 20, pp. 2999—3000, doi:10.1055/s-0032-1317486
- ↑ Moussa, Z., "The Hendrickson 'POP' reagent and analogues thereof: synthesis, structure, and application in organic synthesis", Arkivoc, vol. 2012, no. 1, pp. 432—490, doi:10.3998/ark.5550190.0013.111
- ↑ . ISBN 0471936235.
{{cite encyclopedia}}:|title=пропущен или пуст () - ↑ Das, H. (1965). "Oligomers of diphenylketene". Recueil des Travaux Chimiques des Pays-Bas. 84 (8): 965—978. doi:10.1002/recl.19650840802.
- ↑ Losse, G. (1961), "Diphenylketen als Reagens zur Knüpfung von Peptidbindungen", Ber. Dtsch. Chem. Ges., vol. 94, no. 7, pp. 1762—1766, doi:10.1002/cber.19610940713
- ↑ Staudinger, H.; Dyckerhoff, K.; Klever, H.W.; Ruzicka, L. (1925), "Über Autoxidation organischer Verbindungen. IV.: Über Autoxidation der Ketene", Ber. Dtsch. Chem. Ges., vol. 58, no. 6, pp. 1079—1087, doi:10.1002/cber.19250580618
- ↑ Wittig, G.; Haag, A. (1963), "Über Phosphin-alkylene als olefinbildende Reagenzien, VIII. Allelderivate aus Ketenen", Ber. Dtsch. Chem. Ges., vol. 96, no. 6, pp. 1535—1543, doi:10.1002/cber.19630960609
- ↑ (Thesis) (нем.).
{{cite thesis}}:|title=пропущен или пуст () - ↑ Staudinger, H. (1907), doi:10.1002/jlac.19073560106
{{citation}}:|title=пропущен или пуст () - ↑ Staudinger, H. (1907), "Zur Kenntnis der Ketene. Diphenylketen", Liebigs Ann. Chem., vol. 356, no. 1—2, pp. 51—123, doi:10.1002/jlac.19073560106
- ↑ Smith, L.I.; Hoehn, H.H. (1939), "The reaction of diphenylketene and phenylacetylene", J. Am. Chem. Soc., vol. 61, no. 10, pp. 2619—2624, doi:10.1021/ja01265a015
- ↑ Tidwell, T.T. (2005), "The first century of ketenes (1905–2005): The birth of a versatile family of reactive intermediates", Angew. Chem., vol. 44, no. 36, pp. 5778—5785, doi:10.1002/anie.200500098
2CO-O-CO-{}}}{\text{Z-Leu }}{\ce {->[{} \atop {\ce {H-Phe-OEt}}]}}{\text{ Z-Leu}}{\ce {-Phe-OEt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7b4b915bc917b7c77143009ead9cc799bd83acc)












