Ди-трет-бутилдикарбонат
Ди-трет-бутилдикарбонат[1] | |
|---|---|
 | |
Общие | |
| Систематическое наименование | ди-трет-бутилдикарбонат |
| Сокращения | Boc2O |
| Традиционные названия | ди-трет-бутилпирокарбонат |
| Хим. формула | C₁₀H₁₈O₅ |
Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 218,25 г/моль |
| Плотность | 0,95 г/см³ |
Термические свойства | |
| Т. плав. | 22—24 ℃ |
| Т. кип. | 56—57 ℃ (0,5 мм рт. ст.) |
| Т. всп. | 37 °C |
Оптические свойства | |
| Показатель преломления | 1,4103 |
Классификация | |
| Номер CAS | 24424-99-5 |
| PubChem | 90495 |
| ChemSpider | 81704 |
| Номер EINECS | 246-240-1 |
| RTECS | HT0230000 |
| ChEBI | 48500 |
CC(C)(C)OC(=O)OC(=O)OC(C)(C)C | |
InChI | |
InChI=1S/C10H18O5/c1-9(2,3)14-7(11)13-8(12)15-10(4,5)6/h1-6H3 | |
Безопасность | |
| R-фразы | R10, R26, R36/37/38, R43 |
| S-фразы | S7/9, S16, S26, S28, S36/37, S45 |
| H-фразы | H226, H315, H317, H319, H330, H335 |
| P-фразы | P260, P280, P284, P305+P351+P338, P310 |
| Сигнальное слово | Опасно |
| Пиктограммы СГС | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Ди-трет-бутилдикарбонат — реагент, широко используемый в органическом синтезе для защиты аминогрупп и получения Boc-производных аминов. Представляет собой бесцветную жидкость с характерным резким запахом.
Получение
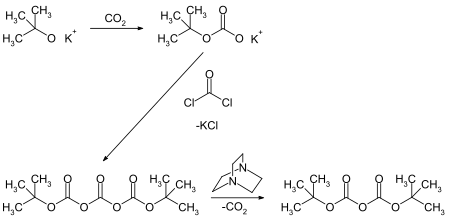
Ди-трет-бутилдикарбонат получают действием фосгена на трет-бутилкарбонат калия с последующим разложением полученного ди-трет-бутилтрикарбоната под действием основных катализаторов, например, 1,4-диазабицикло[2.2.2]октана (DABCO)[2].
Физические свойства
Ди-трет-бутилдикарбонат хорошо растворим в большинстве органических растворителей (декалин, толуол, четырёххлористый углерод, тетрагидрофуран, диоксан, спирты, ацетон, ацетонитрил, диметилформамид), но нерастворим в холодной воде[2].
Применение в органическом синтезе
Ди-трет-бутилдикарбонат широко применяется для введения трет-бутоксикарбонильной (Boc) защитной группы в амины. Данная группа может быть удалена в кислой среде (обычно проводят удаление трифторуксусной кислотой) либо при нагревании. Данная защитная группа устойчива в основной среде и не подвержена действию многих нуклеофилов. Такая стратегия защиты нашла применение не только в синтезе пептидов, но и была расширена на синтез углеводов и алкалоидов[2].
Ди-трет-бутилдикарбонат быстро реагирует с аминами в органических растворителях, давая Boc-производные. При этом в качестве побочных продуктов образуются лишь трет-бутиловый спирт и диоксид углерода, которые легко удаляются при упаривании растворителя. Алифатические и ароматические амины удавалось защищать в различных условиях. Анилины иногда необходимо кипятить с реагентом в тетрагидрофуране, чтобы получить искомый продукт с хорошим выходом[2].
В щелочной среде ди-трет-бутилдикарбонат реагирует с фенолами, давая Boc-производные по гидроксильной группе. В присутствии катализатора межфазного переноса удаётся защищать также спирты, енолы и тиолы. В присутствии DMAP с ди-трет-бутилдикарбонатом реагируют даже амиды и лактамы, обладающие слабыми нуклеофильными свойствами[2].
Ди-трет-бутилдикарбонат может использоваться и для активации карбоксильной группы. В присутствии пиридина он образует смешанные ангидриды с карбоновыми кислотами, которые могут реагировать с ещё одним эквивалентом карбоновой кислоты, давая симметричные ангидриды, либо с другими нуклеофилами. При этом важно, чтобы смешанный ангидрид реагировал с нуклеофилом быстрее, чем сам ди-трет-бутилдикарбонат[2].
Хранение и использование
Реагент следует хранить в холодильнике и не допускать контакта с влагой. Также ди-трет-бутилдикарбонат нельзя нагревать выше 80 °С. Вещество огнеопасно[2].
Примечания
- ↑ Sigma-Aldrich. Di-tert-butyl dicarbonate. Дата обращения: 3 января 2015.
- ↑ 1 2 3 4 5 6 7 Wakselman M. Di-t-butyl Dicarbonate (англ.) // e-EROS Encyclopedia of Reagents for Organic Synthesis. — Wiley, 2001. — doi:10.1002/047084289X.rd060.
Ссылки
- Sigma-Aldrich. ИК-спектр ди-трет-бутилдикарбоната. Дата обращения: 3 января 2015. Архивировано 24 сентября 2015 года.
- Sigma-Aldrich. КР-спектр ди-трет-бутилдикарбоната. Дата обращения: 3 января 2015. Архивировано 8 января 2015 года.
- Sigma-Aldrich. ЯМР-спектр ди-трет-бутилдикарбоната. Дата обращения: 3 января 2015. Архивировано 24 сентября 2015 года.
















