Дозовая компенсация

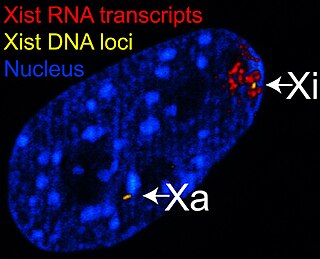
Дозовая компенсация генов — эпигенетические механизмы, позволяющие уравнять уровень экспрессии сцепленных с полом генов у самцов и самок тех видов, в которых определение пола происходит с помощью половых хромосом. Так, например, у самцов млекопитающих гены X-хромосомы, не считая псевдоаутосомных областей, присутствуют в одной копии, а у самок — в двух. Поскольку такая разница могла бы привести к серьёзным аномалиям, существуют механизмы дозовой компенсации генов, не связанных непосредственно с определением пола. У млекопитающих это осуществляется с помощью инактивации одной X-хромосомы в клетках самок таким образом, что в каждой соматической клетке особи любого пола на диплоидный набор хромосом приходится только одна активная X-хромосома.
История исследования

В 1949 году Мюррей Барр и Эварт Бертрам, исследуя кариотип клеток кошек, заметили, что в ядрах самок имеется плотное тельце, отличное от ядрышка, однако его нет в клетках кошек мужского пола. Они называли эту структуру половым хроматином. Позже она стала более известна как тельце Барра. В 1959 году Сусуму Оно выяснил, что тельце Барра — это сверхконденсированная X-хромосома[1]. В 1961 году Мэри Лайон предложила гипотезу, согласно которой инактивация X-хромосомы обеспечивает дозовую компенсацию генов, а выбор хромосомы, которая будет «выключена», происходит случайно. Такие выводы Лайон сделала на основе исследования клеток с аномальным количеством хромосом, в частности с трисомиями по половым хромосомам и полиплоидией. Были получены следующие результаты:
| Кариотип: | Кол-во инактивированных X-хромосом |
| Нормальная женщина (XX + 44 аутосомы): | 1 |
| Нормальный мужчина (XY + 44 аутосомы): | 0 |
| Женщина с трисомией по X-хромосоме (XXX + 44 аутосомы): | 2 |
| Мужчина с синдромом Кляйнфельтера (XXY + 44 аутосомы): | 1 |
| Тетраплоидные женские клетки (XXXX + 88 аутосом): | 2 |

Из полученных результатов был сделан вывод, что клетки имеют какой-то механизм «счёта» X-хромосом и оставляют одну активную X-хромосому на пару аутосом. В пользу гипотезы о случайности выбора хромосомы, подлежащей преобразованию в гетерохроматин, свидетельствовали наблюдения мозаичной окраски у самок мышей, гетерозиготных по X-сцепленным генам, отвечающим за окраску меха. Мозаичность возникает из-за того, что инактивация одной из X-хромосом происходит в клетках зародыша в период гаструляции и митотически наследуется таким образом, что клон каждой из этих клеток сохраняет активной одну и ту же X хромосому: материнского или отцовского происхождения. Похожие результаты, свидетельствующие о мозаичности, были получены при исследовании изоформ глюкозо-6-фосфатизомеразы, которая кодируется геном X-хромосомы у людей.
Полученные результаты быстро нашли применение как в биологических исследованиях, так и за их пределами. Так, в 1965 году Стэнли Гартлер использовал инактивацию X-хромосомы, чтобы доказать клональное происхождение раковых опухолей. А в 1966 году на Олимпийских играх детекция телец Барра стала использоваться для подтверждения пола спортсменов.
Наибольшее количество информации о молекулярных механизмах дозовой компенсации у млекопитающих было накоплено благодаря работам, проведённым на эмбриональных стволовых клетках.
Система XX/XY

Различные виды используют различные механизмы дозовой компенсации: случайную или импринтированную инактивацию одной из X-хромосом у гомогаметного пола (у млекопитающих), двукратное увеличение активности экспрессии с одной из X-хромосом гетерогаметного пола (у плодовой мушки) или двукратное её уменьшение с обеих X-хромосом гомогаметного пола (у нематоды Caenorhabditis elegans). Независимо от конкретного механизма, компенсация всегда происходит только у одного из полов и является необходимым условием его жизнедеятельности.
У дрозофилы и млекопитающих в осуществлении дозовой компенсации задействованы некодирующие РНК, которые покрывают регулируемую X-хромосому, а также осуществляется специфическая для пола модификация белков — гистонов на соответствующей хромосоме.
Млекопитающие
У плацентарных млекопитающих дозовая компенсация генов происходит путём случайной инактивации одной из X-хромосом. Этот процесс происходит примерно в период гаструляции (у человека приблизительно на 12-й день). Все потомки определённой клетки сохраняют инактивированной ту же хромосому, что и материнская клетка, то есть, как и другие эпигенетические метки, эта митотически наследуется. Перепрограммирование X-инактивации происходит в примордиальных клетках зародышевой линии. Ключевую роль в обеспечении инактивации X-хромосомы играет длинная некодирующая РНК Xist, которая действует как цис-регуляторный элемент, то есть влияет именно на ту хромосому, с которой транскрибируется.
Часть генов на X-хромосоме избегают инактивации, в частности псевдоаутосомная область, то есть такие, которые имеют гомологичные последовательности на Y-хромосоме, и некоторые другие гены, которые, возможно, оказывают влияние на формирование половых признаков. Таких участков значительно больше у людей, чем у мышей. Активным на Xi остается также ген XIST.
Однопроходные

Однопроходные — отряд млекопитающих, который включает в себя утконосов и четыре вида ехидновых, которые относятся к яйцекладущим млекопитающим. Хотя однопроходные тоже используют систему XX/XY, но в отличие от остальных млекопитающих, у них присутствует более одного набора половых хромосом. Самцы короткоклювой ехидны, например, имеют девять половых хромосом — 5 X и 4 Y, а самцы утконоса — 5 X-хромосом и 5 Y-хромосом. Недавнее исследование[2] обнаружило, что четыре Х-хромосомы утконоса, также как и Y-хромосома, гомологичны некоторым участкам Z-хромосомы птиц. Хромосома X1 утконоса имеет гомологию с Z-хромосомой курицы, и обе обладают гомологией с 9-й хромосомой человека. Открытие этой гомологии важно для понимания механизма дозовой компенсации однопроходных. В 50 % клеток самок утконоса экспрессируется только один аллель из всех X-хромосом, в то время как оставшиеся 50 % клеток экспрессируют множество разных аллелей. Хотя хромосома утконоса X1 имеет 11 генов, которые обнаруживаются во всех X-хромосомах млекопитающих, а хромосома X5 имеет ген, который называется DMRT1 и встречается в Z-хромосоме у птиц, являясь ключевым полообразующим геном птиц, в целом геномные исследования показали, что пять половых X-хромосом утконоса гомологичны Z-хромосоме птиц[3]. У утконоса не обнаружен ген SRY (ключевой ген определения пола у млекопитающих). Для него характерна неполная дозовая компенсация, недавно описанная у птиц. Видимо, механизм определения пола утконоса сходен с таковым у его предков-рептилий.
Drosophila melanogaster
У плодовой мушки Drosophila melanogaster, хотя определение пола, как и у млекопитающих, происходит с помощью половых хромосом, телец Барра в ядрах самок нет. Зато X-хромосома самцов становится гиперактивной, уровень экспрессии её генов достигает суммарного уровня экспрессии с обеих X-хромосом самок. В обеспечении такой активности ключевую роль играет рибонуклеопротеиновый комплекс MSL (англ. Male specific lethal), который, как свидетельствует его название, является необходимым для жизнедеятельности самцов[4]. В состав MSL входят белки продукты генов msl1, msl2, msl3, mle, mof, что вместе с некодирующими РНК RoX1 и RoX2 формируют компенсасому. Компенсасомы присоединяются к сотням генов, сцепленным X-хромосомой самцов, и избирательно усиливают транскрипцию некоторых из них, доводя её до уровня экспрессии в организме самок. Экспрессия по крайней мере некоторых из msl-генов находится под негативным контролем продукта гена Sxl (англ. Sex lethal), участвующего в подсчёте X-хромосом и определении пола[5][6].
Caenorhabditis elegans
У нематоды C. elegans пол определяется количеством X-хромосом: у самцов она одна, а у гермафродитов — две. Механизм дозовой компенсации у этих животных запускается тем же сигнальным путём, что и определение пола, но контролируется другой группой генов. Заключается этот механизм в двукратном снижении активности транскрипции на обеих X-хромосомах гермафродитов.
Определение пола и запуск дозовой компенсации начинается с подсчёта количества X-хромосом на одну аутосому. X: A-сигнал у самцов (X0) запускает экспрессию гена xol-1 , что определяет развитие зародыша по мужскому типу, а также подавляет экспрессию белка SCD-2. Наличие последнего является необходимым и достаточным условием для активации дозовой компенсации, которая, таким образом, происходит только у гермафродитов. SCD-2 также обеспечивает направление комплекса дозовой компенсации в X-хромосому. Этот мультимерний комплекс содержит много белков, которые имеют другие функции в клетке (например, MIX-1 задействован в различении хромосом в анафазе), или родственные с такими белками (в частности, белки DPY-26 DPY-27 и DPY-28 похожи на белки конденсинового комплекса, участвуют в упаковке митотических (и мейотических) хромосом). Комплекс дозовой компенсации присоединяется к X-хромосоме в нескольких местах, после чего его ингибирующее действие может распространяться на короткие или значительные расстояния.
Silene latifolia
Как люди и мухи, некоторые растения тоже используют XX/XY-систему определения пола и соответствующие механизмы дозовой компенсации. Silene latifolia (Смолёвка белая) несёт либо мужской (XY) либо женский (XX) набор хромосом, причём Y-хромосома меньше, чем Х-хромосома, и, соответственно, меньше количество экспрессируемых с неё генов. Два независимых исследования[7] показали, что у мужских особей смолёвки экспрессия генов, сцепленных с Х-хромомсомой, составляет 70 % от экспрессии у женских особей. Если бы S. latifolia не использовала дозовую компенсацию, то ожидаемый уровень экспрессии генов, сцепленных с X-хромосомой мужских особей, составил бы 50 % от женского. Хотя это растение и имеет определённую дозовую компенсацию, экспрессия генов мужских особей всё равно не достигает 100 % от женских, поэтому было выдвинуто предположение, что система дозовой компенсации S. latiforia всё ещё находится в процессе эволюции. Кроме того, у видов растений, которые не обладают различающимися половыми хромосомами, дозовая компенсация может активироваться в ходе абберентных митозов или анеуплоидии и полиплоидии. Экспрессия генов на подвергнувшихся удвоению/делеции парах хромосом может усиливаться или ослабляться, чтобы компенсировать вредное воздействие и вернуть уровень экспрессии к норме.
Система ZZ/ZW
ZZ/ZW система определения пола есть у большинства птиц, некоторых рептилий, а также чешуекрылых. В этой системе Z — бо́льшая по размеру хромосома, так что гомогаметные самцы (ZZ) вынуждены инактивировать часть генетического материала, чтобы уравновесить экспрессию с самками (ZW), которые несут маленькую W-хромосому. Вместо того, чтобы гетерохроматизировать всю хромосому, как это происходит у людей, петухи (модельный организм) используют селективное подавление, то есть сайленсингу подвергаются только некоторые гены на второй Z-хромосоме[8][9]. Таким образом, у петухов экспрессируется в среднем 1,4-1,6 от суммарного ДНК Z-хромосомы, экспрессируемого у куриц[10]. Экспрессия генов Z-хромосомы у самцов зебровой амадины и петухов выше, чем уровень экспресси аутосомных генов, а вот у человека уровень экспресси X-хромосомы у женщины равен уровню экспресси генов аутосом[11], что ясно указывает на то, что у петухов и самцов зебровых амадин происходит неполный сайленсинг. Так же детально, как и у домашней курицы, система ZZ/ZW была изучена лишь у немногих организмов; последние исследования этой системы у шелкопрядов[12] обнаружили схожую неполную компенсацию по генам Z-хромосомы. Z-сцепленные гены интенсивнее экспрессировались у самцов по сравнению с самками, а несколько генов были активны в равной степени как у самцов, так и у самок.
Эпигенетический механизм дозовой компенсации у домашней курицы
Хотя в сравнении с механизмом дозовой компенсации у человека и дрозофилы эпигенетический механизм дозовой компенсации у птиц всё ещё плохо изучен, последние исследования в этой области выявили важные детали этого процесса. Одна из таких деталей — это MHM (англ. male hypermethylated), Xist-подобная длинная некодирующая РНК, которая экспрессируется только у куриц (ZW). Она связана со специфичным для организма самок гиперацетилированием гистона 4 по 16 лизину, неподалёку от локуса MHM в Z-хромосоме. Этот локус активно изучается, поскольку он, по-видимому, является сайтом дозовой компенсации, Z-хромосомы самцов гиперметилированы, и поэтому экспрессия генов этого локуса снижена по сравнению с половыми хромосомами самок, которые гиперацетилированы, а соответствующие гены активно экспрессируются[13].
Как и у млекопитающих, у домашней курицы метилируются CpG-островки. Одно из исследований обнаружило, что CpG-островки находятся в основном в компенсаторной области Z-хромосомы, которые по-разному экспрессируются у куриц и петухов. По этой причине весьма вероятно, что эти CpG-островки локализованы в тех генах, которые на Z-хромосоме самцов метилируются и выключаются, но остаются активными в Z-хромосоме самок.
Импринтированная инактивация X-хромосомы
Иногда инактивация X-хромосомы может происходить не случайно. Например, у сумчатых этому процессу всегда подлежит хромосома отцовского происхождения. Это явление называется импринтированной инактивацией и считается эволюционно примитивным механизмом[14].
Импринтированная инактивация изредка может проявляться и у плацентарных млекопитающих, например, мышей. У этих грызунов на стадии 2-4 бластомеров родительская X-хромосома переходит в состояние гетерохроматина. Такая закономерность инактивации сохраняется в трофобласте бластоцисте, которые участвует в формировании плаценты, в то время как в клетках эмбриобласта позже происходит перепрограммирование: сначала все хромосомы переходят в активное состояние, после чего происходит случайная инактивация[15].
Примечания
- ↑ Ohno S., Kaplan W. D., Kinosita R. Formation of the sex chromatin by a single X-chromosome in liver cells of rattus norvegicus (англ.) // Exp Cell Res[англ.] : journal. — 1959. — Vol. 18. — P. 415—419. — doi:10.1016/0014-4827(59)90031-X. — PMID 14428474.
- ↑ Deakin, Janine, et al (2008). The Status of Dosage Compensation in the Multiple X Chromosomes of the Platypus. PLoS Genetics, 4(7).
- ↑ Warren, Wesley C. Genome analysis of the platypus reveals unique signatures of evolution (англ.) // Nature : journal. — 2008. — 8 May (vol. 453, no. 7192). — P. 175—183. — doi:10.1038/nature06936. Архивировано 5 марта 2016 года.
- ↑ Dahlsveen, Ina, et al (2006). Targeting Determinants of Dosage Compensation in Drosophila, PLOS Genetics, 2(2).
- ↑ Zhou, Qi (2013). The Epigenome of Evolving Drosophila Neo-Sex Chromosomes: Dosage Compensation and Heterochromatin Formation. PLoS Biology, 11 (11), 1-13
- ↑ *Deng, Xinxian and Meller, Victoria H. (2009). Molecularly severe roX1 mutations contribute to dosage compensation in Drosophila. Genesis, 47 (1), 49-54
- ↑ Meadows, Robin (2012). Sex Chromosome Equality in Plants. PLoS Biology, 10(4). e1001312.
- ↑ Yukiko, Kuroda, et al (2001). Absence of Z-chromosome inactivation for five genes in male chickens. Chromosome Research, 9 (6), 457—468.
- ↑ McQueen, Heather, et al (2001). Dosage compensation in birds. Current Biology, 11 (4), 253—257.
- ↑ Ellegren, Hans, et al (2007). Faced with inequality: chicken do not have a general dosage compensation of sex-linked genes. BMC Biology, 5 (40).
- ↑ Itoh, Yuichiro, et al (2007). Dosage compensation is less effective in birds than in mammals. Journal of Biology, 6 (1)
- ↑ Zha, Xingfu, et al (2009). Dosage analysis of Z chromosome genes using microarray in silkworm, Bombyx mori. Insect Biochemistry and Molecular Biology, 29 (5-6), 315—321.
- ↑ Melamed, Esther and Arnold, Arthur (2009). The role of LINEs and CpG islands in dosage compensation on the chicken Z chromosome"Chromosome Research, 17(6), 727—736.
- ↑ * Morey C., Avner P. The demoiselle of X-inactivation 50 years old and as trendy and mesmerising as ever (англ.) // PLoS Genetics[англ.] : journal. — WormBook, 2011. — July. — doi:10.1371 / journal.pgen.1002212. — PMID 21811421.
- ↑ * Berletch J. B., Yang F., Disteche C. M. Escape from X inactivation in mice and humans (англ.) // BioMed Central[англ.] : journal. — June 2010. — Vol. 11, no. 6. — doi:10.1186/gb-2010-11-6-213. — PMID 20573260.
Литература
- Tamarin R. H. Principles of Genetics (неопр.). — 7th. — McGraw-Hill Education, 2001. — С. 90—95. — ISBN 0072334193.
- Meyer Barbara. X-Chromosome dosage compensation (англ.). WormBook (2005). Дата обращения: 30 июня 2013.