
Цитозо́ль — жидкое содержимое клетки. Большую часть цитозоля занимает внутриклеточная жидкость. Цитозоль разбивается на компартменты при помощи разнообразных мембран. У эукариот цитозоль располагается под плазматической мембраной и является частью цитоплазмы, в которую, помимо цитозоля, входят митохондрии, пластиды и другие органеллы, но не содержащаяся в них жидкость и внутренние структуры. Таким образом, цитозоль представляет собой жидкий матрикс, окружающий органеллы. У прокариот большая часть химических реакций метаболизма происходит в цитозоле, и лишь небольшая их часть происходит в мембранах и периплазматическом пространстве. У эукариот, хотя многие реакции протекают в органеллах, некоторые реакции, например, гликолиз или синтез жирных кислот, происходят в цитозоле.
Эндонуклеазы рестрикции, рестриктазы — группа ферментов, относящихся к классу гидролаз, катализирующих реакцию гидролиза нуклеиновых кислот.

Никотинамидадениндинуклеоти́д — кофермент, имеющийся во всех живых клетках. NAD представляет собой динуклеотид и состоит из двух нуклеотидов, соединённых своими фосфатными группами. Один из нуклеотидов в качестве азотистого основания содержит аденин, другой — никотинамид.
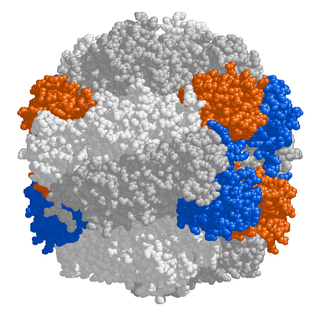
Рибулозобисфосфаткарбоксилаза, рубиско — фермент, катализирующий присоединение углекислого газа к рибулозо-1,5-бисфосфату на первой стадии цикла Кальвина, а также реакцию окисления рибулозобифосфата на первой стадии процесса фотодыхания. Является одним из важнейших ферментов в природе, поскольку играет центральную роль в основном механизме поступления неорганического углерода в биологический круговорот. Рибулозобисфосфаткарбоксилаза является основным ферментом листьев растений и поэтому считается наиболее распространённым ферментом на Земле.

Протеасо́ма — многобелковый комплекс, разрушающий ненужные или дефектные белки при помощи протеолиза до коротких пептидов. Эти пептиды затем могут быть расщеплены до отдельных аминокислот. Протеасомы присутствуют в клетках эукариот, архей и некоторых бактерий. В эукариотических клетках протеасомы содержатся и в ядре, и в цитоплазме. Деградация 80—90 % внутриклеточных белков происходит при участии протеасомы. Для того чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитинлигазами. Присоединение первой молекулы убиквитина к белку служит для убиквитинлигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени. В целом вся эта система получила название убиквитин-зависимой деградации белка.

Селеноцистеи́н — 21-я протеиногенная аминокислота, аналог цистеина с заменой атома серы на атом селена. Входит в состав активного центра фермента глутатионпероксидазы, а также в состав селенопротеинов, деиодаз и некоторых других белков. На мРНК селеноцистеин кодируется терминирующим кодоном UGA при условии, что за ним следует особая стимулирующая последовательность нуклеотидов.

Система рестрикции-модификации — ферментативная система бактерий, разрушающая попавшую в клетку чужеродную ДНК. Основная её функция — защита клетки от чужеродного генетического материала, например, бактериофагов и плазмид. Для компонентов системы характерны два типа активности — метилтрансферазная (метилазная) и эндонуклеазная. За каждую из них могут отвечать как отдельные белки, так и один белок, сочетающий в себе обе функции.
Протеинкина́зы — подкласс ферментов киназ (фосфотрансфераз). Протеинкиназы модифицируют другие белки путём фосфорилирования остатков аминокислот, имеющих гидроксильные группы или гетероциклической аминогруппы гистидина.
Секвенирование спаренных концов — один из методов секвенирования ДНК нового поколения, основанный на получении и секвенировании библиотеки спаренных концевых фрагментов, в которой короткие 5’- и 3’- концевые участки фрагментов ДНК/кДНК соединены друг с другом.
Белок эксцизионной репарации ДНК ERCC-6 — белок, кодируемый у человека геном ERCC6 . Ген ERCC6 расположен на длинном плече хромосомы 10 в позиции 11.23.

НАДН-дегидрогена́зный ко́мплекс, также называемый ко́мплекс I или НАДН-убихино́н-оксидоредукта́за — первый мультибелковый комплекс дыхательной цепи переноса электронов. Множество копий комплекса расположены в мембранах прокариотических организмов, способных к кислородному дыханию и внутренних мембранах митохондрий эукариотических клеток. По отношению к белкам человека комплекс I часто называют НАДН-дегидрогеназой.
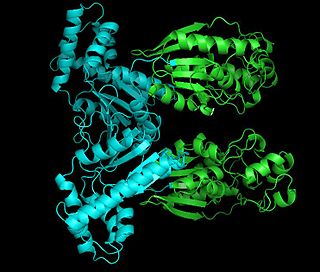
Фосфофруктокиназа-2 (ФФК-2) или фруктозо-2,6-бисфосфатаза (ФБФ-2) — бифункциональный фермент, регулирующий процессы гликолиза и глюконеогенеза в теле человека. Этот белок является димером, в котором каждый мономер, в зависимости от внешних условий, может действовать как киназа или фосфатаза. Регулируется глюкагоном и инсулином.

RecBCD — фермент бактерии Escherichia coli, инициирующий процесс гомологичной рекомбинации при репарации двух- и одноцепочечных повреждений молекулы ДНК, возникающих в результате ионизирующего излучения, ошибок в процессе репликации, ошибок в работе эндонуклеаз или в результате окислительного стресса. RecBCD — это одновременно и хеликаза, раскручивающая двойную спираль ДНК, и нуклеаза, которая её разрезает.

REBASE — база данных, содержащая информацию об эндонуклеазах рестрикции и ДНК-метилтрансферазах. REBASE содержит обширный набор ссылок, сайтов узнавания и расщепления, последовательностей и структур, а также информацию о коммерческой доступности каждого фермента. REBASE является одной из старейших биологических баз данных, она ведёт свои корни из коллекции рестриктаз собранной Ричардом Робертсом ещё до 1980 года. C того времени в журнале Nucleic Acids Research регулярно публикуются описания этой баз данных.
То́чка рестри́кции (англ. restriction point, R point) — точка в G1-фазе клеточного цикла животных, в которой клетка принимает окончательное решение двигаться дальше по клеточному циклу. Точка рестрикции делит G1-фазу на два периода. В ходе первого из них (до R) для продвижения клетки по циклу ей необходима постоянная стимуляция митогенными сигналами (в том числе факторами роста), а также интенсивный синтез белка. После прохождения R подобная стимуляция уже не требуется.
XbaI - эндонуклеаза рестрикции, выделенна из бактерии Xanthomonas badrii.

Сборка Golden Gate, также клонирование Golden Gate , — метод клонирования ДНК, который позволяет одновременно и упорядоченно собирать несколько фрагментов ДНК в один с помощью эндонуклеаз рестрикции IIs типа и ДНК-лигазы бактериофага T4. Сборка молекулы проводится in vitro. Наиболее часто используемые эндонуклеазы рестрикции типа IIs включают BsaI, BsmBI, and BbsI.
Ферментный промискуитет (неразборчивость) — это способность фермента катализировать случайную побочную реакцию в дополнение к своей основной реакции. Хотя ферменты являются чрезвычайно специфическими катализаторами, они часто могут выполнять побочные реакции в дополнение к своей основной природной каталитической активности. Побочная активность фермента обычно протекает медленнее по сравнению с основной деятельностью и находится под нейтральным отбором. Несмотря на то, что обычно эти активности физиологически нерелевантны, в условиях нового избирательного давления эти виды деятельности могут принести пользу, тем самым побуждая эволюцию ранее побочных активностей стать новым основным видом деятельности. Примером этого является хлоргидролаза атразина (кодируется atzA) Pseudomonas sр., произошедшая из меламиндезаминазы, которая имеет очень небольшую побочную активность в отношении атразина, химического вещества, созданного руками человека.
Дезоксирибонуклеаза IV — это вид эндонуклеазы, которая катализирует деградацию нуклеотидов в двухцепочечной ДНК, атакуя 5'-терминальный конец.

Переворот оснований ДНК, или переворот нуклеотидов, представляет собой механизм, в котором одиночное основание нуклеотида, или азотистое основание, вращается вне двойной спирали нуклеиновой кислоты. Это происходит, когда ферменту, обрабатывающему нуклеиновую кислоту, требуется доступ к основанию для выполнения работы с ним, например, для его вырезания для замены другим основанием во время репарации ДНК. Впервые он был обнаружен в 1994 году с помощью рентгеновской кристаллографии фермента метилтрансферазы, катализирующего метилирование цитозинового основания в ДНК. С тех пор было показано, что он используется различными ферментами во многих биологических процессах, таких как метилирование ДНК, различные механизмы восстановления ДНК и репликация ДНК. Это также может происходить в двойных спиралях РНК или в интермедиатах «ДНК:РНК», образующихся во время транскрипции РНК.











